



我們首先使用LFA方法,測得了ABTA干品在25℃下的熱擴散系數(shù)。在后續(xù)熱模擬中引用該值,忽略干品與濕品差異、以及熱擴散系數(shù)隨溫度的變化。
隨后使用DSC方法,測得了干品在5~45℃之間的比熱值,更高溫度下則使用外推數(shù)據(jù)。對于濕品,考慮室溫下含水量10%,烘干過程中平均含水量5%,高溫下水含量為0%,結合水的比熱,由質量混合律估算了濕品在多個溫度點下的比熱值,用于熱模擬計算。具體數(shù)值詳見后文。

DSC在四個不同升溫速率(1, 2, 5, 10 K/min)下的分解測試結果如下:

反應包含四個放熱峰,總放熱量約563.3 J/g。
與干品數(shù)據(jù)(見后)相比,濕品曲線上多出了100℃前后的放熱尖峰。經一些補充測試的對比驗證,發(fā)現(xiàn)隨著樣品濕度的下降,該峰會逐漸變小,當濕度 < 5% 時則趨于消失。猜想較多水分的存在,促成了某一不期望的反應,而該反應最終造成濕品在直接烘干的工藝下,發(fā)生放熱失控乃至出現(xiàn)燒焦現(xiàn)象。
初看起來,該峰的溫度很高,即使在1K/min下,溫度也在90℃左右,比烘料溫度(40--50℃)高出不少,似乎在40...50℃溫度下不應產生這一熱效應?
但如果仔細觀察曲線規(guī)律,就會發(fā)現(xiàn)升溫速率越慢,該峰溫度越低。測試所用的升溫速率,最慢的是1K/min,這雖然在一般熱分析測試來說已經算是“很慢”了,但如果升溫速率再下降到0.5K/min,甚至0.2K/min、0.1K/min… 反應溫度又會下降到什么程度?從阿倫尼烏斯方程的指數(shù)形式可知,很多反應并沒有一個明確的“起始溫度”,只是溫度越低,速率越慢。那么可以想象該反應在40…50℃范圍內也在緩慢地發(fā)生,如果給予足夠長的時間,也可能進行到一定的程度。因此不能僅憑動態(tài)升溫條件下的DSC曲線所得反應溫度較高,就武斷地得出在更低溫度下反應不可能發(fā)生這樣的結論。
在這三條DSC曲線背后,實際上包含了反應速率與溫度和轉化率關系的相關信息。現(xiàn)在我們對數(shù)據(jù)進行動力學建模,本質上是將這些信息收集起來,抽象成描述 (轉化率~時間~溫度 關系)的數(shù)學方程。我們使用了如下的四步反應模型:

即從表觀反應物A出發(fā),經過四階段的反應步驟(對應于DSC曲線上由低溫到高溫的四個放熱峰),最終生成產物E。Cn為自催化機理函數(shù),F(xiàn)n為級數(shù)反應函數(shù),相關數(shù)學細節(jié)從略。使用該模型的擬合結果如下圖:

擬合相關系數(shù)97.4%。得到的動力學參數(shù)為:
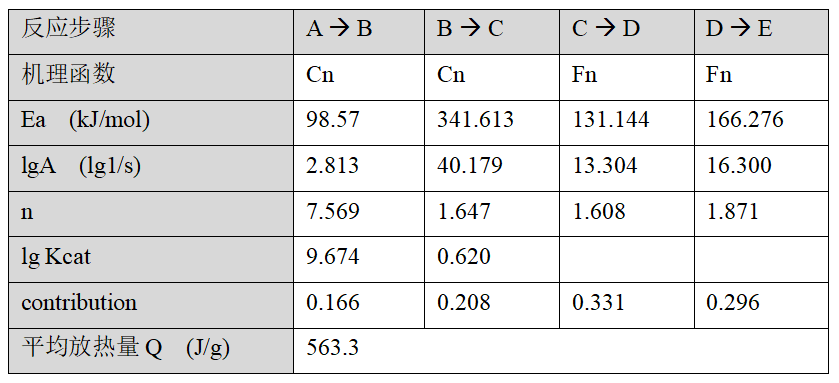
以該動力學模型,對40、45、50℃下等溫24小時的反應過程進行預測,結果如下:
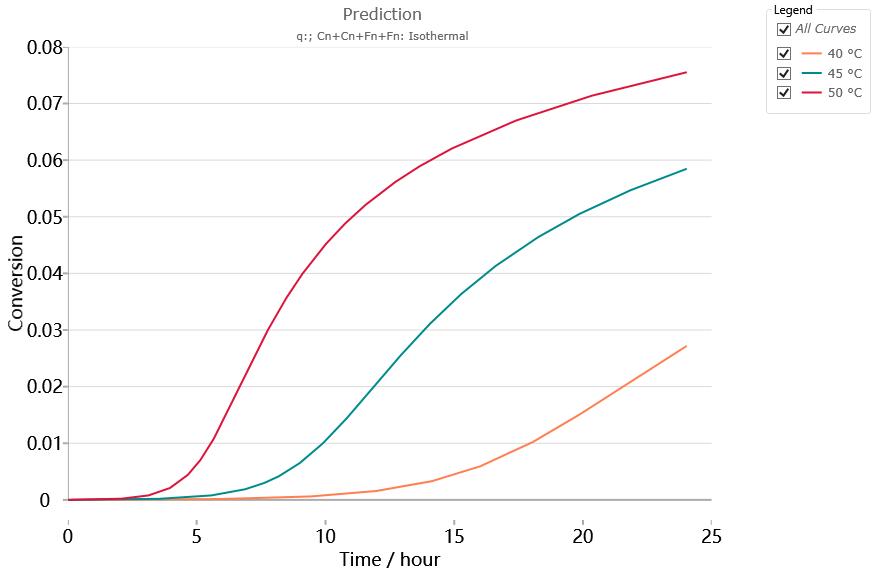
看起來反應似乎比較溫和,在40℃下等溫24小時,最終達到的轉化率為2.7%。即使在50℃下,24小時的最終轉化率也僅為7.5%。
但需要注意的是,動力學等溫預測,模擬的是溫度穩(wěn)定地控制在目標溫度下的反應情況,類似于DSC在理想情況下所能得到的等溫測試結果。對應于工藝,相當于物料在反應過程中的反應熱被充分移除,物料處于溫度穩(wěn)定狀態(tài),沒有任何的熱蓄積。而真實的情況可能是樣品一旦發(fā)生放熱反應,熱量得不到及時而有效的移除,蓄積在物料內部,導致體系溫度上升,而溫度的上升會進一步加速反應,最終可能發(fā)生爆炸式的失控反應。
動力學軟件中的絕熱預測,驗證了這一點,結果顯示對于40…50℃的烘料溫度,在24小時內均會發(fā)生劇烈的兩階段熱失控過程,溫度越高,過程發(fā)生得越早,在絕熱的條件下,物料的最終溫度將達到將近600℃:

實際烘料過程的溫控情況介于理想移熱與絕熱之間,需要使用熱模擬軟件,得到更貼合實際的失控過程模擬。
未完待續(xù)
作者
徐梁
耐馳儀器公司應用實驗室
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發(fā)表之日起一周內與本網聯(lián)系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號




















 采購中心
采購中心