1、肺纖維化模型
大鼠肺纖維化模型
SD大鼠,鼠齡6-8周齡,體重200g左右,氣管內給藥。稱重大鼠,麻醉后將大鼠仰臥固定于實驗臺,切開頸部的皮膚,鈍性分離頸部的肌肉,充分暴露氣管,行氣管切開術,模型組(BLM組)緩慢注人5 mg/kg BLM 0.1mL,立即旋轉動物,使藥液在肺內均勻分;對照組同上方法注入生理鹽水0.1 ml,分籠飼養,自由飲水。期間動物會出現背毛凌亂,體重減輕現象,會有少量死亡現象。
模型鑒定
造模14天后,可進行肺部CT觀測。
HE與MASSON肺組織病理檢測觀察
小鼠肺纖維化模型
成年雄性ICR小鼠,體重25-28g,氣管內給藥。稱重小鼠,麻醉后將小鼠仰臥固定于實驗臺,切開頸部的皮膚,鈍性分離頸部的肌肉,充分暴露氣管,行氣管切開術,模型組(BLM組)緩慢注人5 mg/kg BLM 50 μl,立即旋轉動物,使藥液在肺內均勻分;對照組同上方法注入生理鹽水50 μl,分籠飼養,自由飲水。期間動物會出現背毛凌亂,體重減輕現象,會有少量死亡現象。
2、潰瘍性結腸炎模型
小鼠潰瘍性結腸炎模型
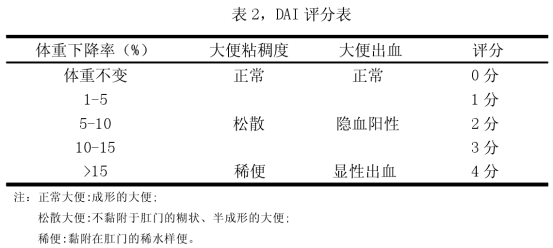
6-8周雄性C57BL/6小鼠,予3%DSS常飲法造模,給DSS14天(小鼠每只/天飲水量大約是5ml),構建小鼠結腸炎模型。在 UC 造模期間,每天稱取小鼠體重,觀察小鼠糞便稠度及出血情況,進行 DAI評分,分別就體重降低、糞便稠度、出血三個參數計算 DAI,DAI=(體重評分+糞便稠度評分+出血評分)/3
(a)體重減少%=[-(實驗當天的體重-原始體重)/原始體重*100,0分≤1%,
1 分=1%-5%,2 分=5%-10%,3 分=10%-15%,4 分≥15%];
(b)糞便稠度(0 分:糞便正常,2 分:糞便稀松,4 分:腹瀉);
(c)出血(0 分:陰性未發現,出血情況,2 分:陽性發現出血情況,4
分:發現嚴重出血情況).
大鼠潰瘍性結腸炎模型
雄性Wistar 大鼠200-230g,予5%DSS常飲法造模,給DSS14天,構建小鼠結腸炎模型。在 UC 造模期間,每天稱取大鼠體重,觀察大鼠糞便稠度及出血情況,進行 DAI評分,進行 DAI評分,分別就體重降低、糞便稠度、出血三個參數計算 DAI,DAI=(體重評分+糞便稠度評分+出血評分)/3
(a)體重減少%=[-(實驗當天的體重-原始體重)/原始體重*100,0分≤1%,
1 分=1%-5%,2 分=5%-10%,3 分=10%-15%,4 分≥15%];
(b)糞便稠度(0 分:糞便正常,2 分:糞便稀松,4 分:腹瀉);
(c)出血(0 分:陰性未發現,出血情況,2 分:陽性發現出血情況,4
分:發現嚴重出血情況).
3、慢性心衰模型
大鼠慢性心衰模型
Wistar雄性大鼠200g-250g,適應性喂養1周后,阿霉素腹腔注射給藥2.5mg/kg/周,連續給藥6周,超聲心電圖記記錄以下血流動力學參數:心率(HR)、左室收縮壓(LVSP)、左室舒張末壓(LVEDP)、舒張壓(DAP)、收縮壓(SAP)、平均動脈壓(MAP)、左室壓力最大上升及下降速度(±dp/dtmax)進行測定。
小鼠慢性心衰模型
體重在25-30g之間的雄性C57BL/6J小鼠,適應性喂養1周。小鼠在建立模型前8小時禁止飲水及進食,每一只小鼠都要稱體重并記錄下體重值,模型組給予鹽酸阿霉素 (輝瑞制藥有 限公 司)腹腔注射 ,2mg/kg,前 5次每 3d注射1次, 以后每 7d注射 1次 ,累計用量 22mg/kg。給藥10周。采用超聲心動圖檢測小鼠心臟功能:心率(HR)、左室收縮壓(LVSP)、左室舒張末壓(LVEDP)、舒張壓(DAP)、收縮壓(SAP)、平均動脈壓(MAP)、左室壓力最大上升及下降速度(±dp/dtmax)。
4、癲癇模型
大鼠癲癇模型
9周齡健康雄性SD大鼠,海馬區腦立體定位注射20 mM海人酸1μl構建癲癇模型,注射海人酸后即可觀察大鼠行為,觀察時間是4h。海人酸注射大鼠發生的癇性發作按Racine分級標準進行判定:0級,無驚厥;I級,咀嚼、眨眼、立須等面部肌肉抽搐;II級,以點頭運動為主的頸部肌肉抽搐;III級,單側前肢陣攣、抽搐;IV級,雙側前肢陣攣、抽搐伴身體立起;V級,雙側后肢強直,身體背曲強直,跌倒伴全身陣攣。0級為正常,I-III級為癲癇部分性發作,IV~V級為癲癇大發作;凡在觀察時間內連續出現3次IV~V級發作者即為成功癲癇模型。
小鼠癲癇模型
8-10周健康雄性C57BL/6小鼠,將小鼠置于立體定位儀上,根據預實驗摸索并優化麻醉劑用量、海人酸注射量和注射部位的各參數,得到以大腦Bregma為原點的海馬定位注射坐標:-2.0、-1.8、-2.3 mm(右側海馬),進行單側注射海人酸12 mg/kg后,觀察其行為表現。以在急性期出現持續l h以上的III 級以上發作,即為成功癲癇模型。
5、帕金森模型
大鼠帕金森模型
選取雄性 SD 大鼠 ,體質量 250 ~300 g,進行腦立體定位手術,麻醉后,將大鼠頭部固定于腦立體定位儀,顱骨暴露出 2 點,腦黑質坐標:(1)anterior-posterior(AP): 5.2 mm; medial-lateral (ML): 1.9 mm; deep ventral(DV): 8.2 mm, (2) AP: 5.5 mm; ML: 2.4 mm; DV: 7.6 mm,并注入藥物,正常對照組每側注入含0.2%抗壞血酸 0.9%氯化鈉注射液 3 μl,6-OHDA 處理實驗組每側注入濃度為 2.5mg/ml 的6-OHDA 溶液3 μl(溶劑為含0.2%抗壞血酸 0.9%氯化鈉注射液)。
鑒定:(1)大鼠經 6-OHDA 損毀兩周后,在黑暗安靜的環境下腹腔注射 APO 溶液(1mg·kg-1),單獨置于籠內,觀察其行為變化,5min 后開始計算旋轉圈數,以向
健(左)側、首尾相接、環曲 360°者計一圈,記錄 5min,若旋轉>7r·min-1 或>35r·5min-1(*毀損)視為建模成功;旋轉<7r·min-1 或<35r·5min-1(部分毀 損)及 15min 無旋轉或向右側旋轉者均視為建模失敗;(2)HE染色觀察腦組織病理學變化
小鼠帕金森模型
C57BL / 6 雄性小鼠,8 周齡,體質量 20 ~ 22 g,小 將動物固定在立體定位儀(上,沿顱 頂矢狀縫切開皮膚,暴露前囟( Bregma)。 在前囟前 (AP)+0. 5 mm,中線旁(ML) -2. 0 mm(右側) 打孔。 微量進樣器緩慢下行,先后分別在 顱骨下(DV)-3. 0 mm 和-2. 0 mm 各注入 6-OHDA 溶 液 0. 78 μL,速度 0. 5 μL·min-1 ,每次注射完成后需 留針 3 min。 勻速退出進樣器,縫合處理創面。
鑒定:術后的 5 周中,每周腹腔注射 0. 125 g·L-1 的 APO(0. 5 μg·g-1 )觀察動物旋轉情況。 將動物放置在 500 mL 的燒杯里,杯底附新鮮干燥墊料,計數 30 min 內,小鼠向未損傷側的旋轉圈數,每旋轉 360 度記為 1 圈。 統計結果以旋轉次數(rotation·30 min-1 )表示。
6、糖尿病模型
大鼠二型糖尿病模型
8周齡雄性SD大鼠(200g左右),用高脂高糖飼料喂養4周后禁食12小時,腹腔注射配制好的鏈脲佐菌素溶液30 mg/kg,連續注射3天。4天后檢測空腹血糖值,當空腹血糖≥ 11.1mmol/L時,并且高血糖持續兩周且無恢復現象者可作為成功模型。
小鼠二型糖尿病模型
C57BL/6 雄性小鼠(20g左右),用高脂高糖飼料喂養4周后禁食12小時,腹腔注射配制好的鏈脲佐菌素溶液30 mg/kg,連續注射3天。4天后檢測空腹血糖值,當空腹血糖≥ 11.1mmol/L時,并且高血糖持續兩周且無恢復現象者可作為成功模型。
參考文獻
[1]Xiong Y, Nie D, Liu S, et al. Apoptotic PET Imaging of Rat Pulmonary Fibrosis With [18F]ML-8. Mol Imaging. 2018;17:1536012118795728. doi:10.1177/1536012118795728
[2]Zhou Y, Li P, Duan JX, et al. Aucubin Alleviates Bleomycin-Induced Pulmonary Fibrosis in a Mouse Model. Inflammation. 2017;40(6):2062-2073. doi:10.1007/s10753-017-0646-x MLA
[3]Cao H, Liu J, Shen P, et al. Protective Effect of Naringin on DSS-Induced Ulcerative Colitis in Mice. J Agric Food Chem. 2018;66(50):13133-13140. doi:10.1021/acs.jafc.8b03942
[4]Zhu L, Gu P, Shen H. Protective effects of berberine hydrochloride on DSS-induced ulcerative colitis in rats. Int Immunopharmacol. 2019;68:242-251. doi:10.1016/j.intimp.2018.12.036
[5]Sun X, Chen G, Xie Y, et al. Qiliqiangxin improves cardiac function and attenuates cardiac remodelling in doxorubicin-induced heart failure rats. Pharm Biol. 2020;58(1):417-426. doi:10.1080/13880209.2020.1761403
[6]馬琴. 阿霉素誘導大鼠慢性心力衰竭模型的制備[J]. 生物化工, 2019, 005(004):P.100-103.
[7]靳文英, 喬正國, 鄭春華,等. 蛋白激酶C結合蛋白1參與心力衰竭小鼠心臟去甲腎腺素轉運蛋白的表達下調[J]. 中華心血管病雜志, 2014, 42(3):219-224.
[8]Klee R, Brandt C, Töllner K, Löscher W. Various modifications of the intrahippocampal kainate model of mesial temporal lobe epilepsy in rats fail to resolve the marked rat-to-mouse differences in type and frequency of spontaneous seizures in this model. Epilepsy Behav. 2017;68:129-140. doi:10.1016/j.yebeh.2016.11.035
[9]張玉奇, 劉衛平, 王彥剛,等. 不同劑量海人酸海馬注射建立大鼠顳葉癲癇模型的實驗研究[J]. 山西醫科大學學報, 2010, 41(005):383-386.
[10]Venceslas D, Corinne R. A Mesiotemporal Lobe Epilepsy Mouse Model. Neurochem Res. 2017;42(7):1919-1925. doi:10.1007/s11064-017-2239-3
[11]何婷婷. 構建海人酸誘導的內側顳葉癲癇小鼠模型[J]. 基礎醫學與臨床, 2011, 31(7):820-826.
[12] Zhu Y, Wang B, Tao K, et al. Iron accumulation and microglia activation contribute to substantia nigra hyperechogenicity in the 6-OHDA-induced rat model of Parkinson's disease. Parkinsonism Relat Disord. 2017;36:76-82. doi:10.1016/j.parkreldis.2017.01.003
[13]韓文迪. 基于腦微透析技術的大鼠中樞左旋多巴藥動學研究及帕金森病大鼠模型的建立[D]. 福建醫科大學, 2011.
[14] 于燕, 王可, 賈軍,等. 紋狀體注射不同劑量6-OHDA制備帕金森病小鼠模型的評價[J]. 首都醫科大學學報, 2015(02):255-261
[15]DAD Magalhães, Kume W T , Correia F S , et al. High-fat diet and streptozotocin in the induction of type 2 diabetes mellitus: A new proposal[J]. Anais da Academia Brasileira de Ciências, 2019, 91(1).
[16]蔡羽. 桑瓜飲干預2型糖尿病大鼠的作用及其PI3K/Akt信號通路機制研究[D]. 湖北中醫藥大學.
[17]STZ加高脂飼料誘導糖尿病C57小鼠成模情況及穩定性的觀察研究[J]. 中醫眼耳鼻喉雜志, 2015(5):22-25.
[18]]葉桂林, 王清清, 楊文杰,等. 高脂飼料聯合STZ誘導建立長期穩定2型糖尿病小鼠模型的給藥方案研究[J]. 南昌大學學報(醫學版), 2018, 058(002):P.9-13.
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號




















 采購中心
采購中心