藥用級環拉酸鈉 YF全部供應信息
藥用級環拉酸鈉 YF全部供應信息
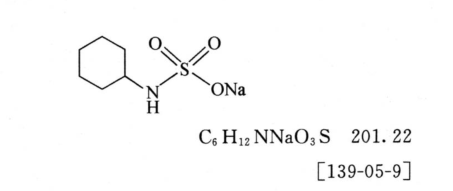 本品為環己氨基磺酸鈉鹽。按干燥品計算,含C6H12NNaO3S不得少于98.0%。 【性狀】本品為白色結晶性粉末。 本品在水中易溶,在中極微溶,在或中不溶。 【鑒別】(1)取本品約0.1g,加水10ml使溶解,加鹽酸1ml與氯化鋇溶液(1→10)1ml,溶液應澄清;再加亞硝酸鈉溶液(1→10)1ml,即產生白色沉淀。 (2)本品的紅外光吸收圖譜應與對照品的圖譜一致(通則0402)。 (3)本品顯鈉鹽的鑒別反應(通則0301)。
本品為環己氨基磺酸鈉鹽。按干燥品計算,含C6H12NNaO3S不得少于98.0%。 【性狀】本品為白色結晶性粉末。 本品在水中易溶,在中極微溶,在或中不溶。 【鑒別】(1)取本品約0.1g,加水10ml使溶解,加鹽酸1ml與氯化鋇溶液(1→10)1ml,溶液應澄清;再加亞硝酸鈉溶液(1→10)1ml,即產生白色沉淀。 (2)本品的紅外光吸收圖譜應與對照品的圖譜一致(通則0402)。 (3)本品顯鈉鹽的鑒別反應(通則0301)。
4、資料按套裝入檔案袋,檔案袋封面注明:申請分類、注冊分類、藥品名稱、本袋所屬第X套第X袋每套共X袋、原件/復印件、申請機構電話。
5、注冊申請報送2套完整申請資料(其中至少1套為原件)和1套綜述資料(可為復印件),各袋均應包含1份申請表。
許可程序
(三)藥品注冊檢驗:
藥品注冊檢驗與技術審評并列進行。
藥品檢驗所在接到注冊檢驗通知和樣品后,應當在30日內完成檢驗,出具藥品注冊檢驗報告,并報送國家食品藥品監督管理局,同時抄送通知其檢驗的省級食品藥品監督管理部門和申請人。
需要進行樣品檢驗和藥品標準復核的,藥品檢驗所應當在60日內完成。
(四)送達:
省局作出行政許可決定后,5日內在省局網站上發布,若申請人10日內未領取批件,電話通知申請人。
自受理之日起,60日內完成現場核查、抽取樣品、通知藥品檢驗所進行注冊檢驗、將審查意見和核查報告連同申請人的申報資料一并報送國家食品藥品監督管理局等工作,同時將審查意見通知申請人。該時限不包括申請人補正資料所需的時間。

















 化工儀器網
化工儀器網