貼壁/懸浮細胞瞬時轉染-RFect質粒DNA轉染操作步驟和注意事項
本文以RFect Plasmid DNA Transfection Reagent(RFect質粒DNA轉染試劑盒),作為攜帶質粒穿膜的載體物質,具體介紹DNA轉染方法。
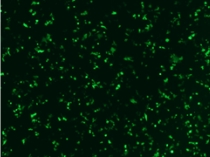
圖. 用本產品4ul轉染1ug pEGFP-C2質粒到293T細胞后,綠色熒光蛋白的表達情況。
貼壁/懸浮細胞瞬時轉染-RFect質粒DNA轉染方法步驟:
一、貼壁/懸浮細胞瞬時轉染操作流程(以24孔板轉染為例)
A. 細胞接種:
1. 轉染前24小時左右對細胞進行轉接,接種密度約為每孔0.3~1×105個細胞;
2. 過夜培養。
B. RFect /DNA復合物包裝(該步完成后應立即轉染):
1. 在1.5 ml無菌離心管中加入50 μl無血清培養基,并添加適量的轉染試劑(2~5 μl/μg DNA,參見下表)。用移液器輕輕混勻后在室溫靜置5~10分鐘。
2. 在1.5 ml無菌離心管中加入50 μl無血清培養基,并添加適量的DNA(0.8~1μgDNA/孔, 參見附表)。用移液器輕輕混勻后在室溫靜置5~10分鐘。
3. 將RFect-培養基混合物滴加至DNA-培養基混合物中,用移液器輕輕混勻后在室溫靜置15~20分鐘后,立即轉染。注意: RFect-培養基混合物和DNA-培養基混合物的混合次序非常重要,切勿顛倒。
C.貼壁/懸浮細胞瞬時轉染-RFect質粒DNA轉染:
注意:RFect在*培養基中(基礎培養基中添加血清)具有很高的轉染效率,因此轉染前后不需要換成無血清培養基。
1. 如特殊情況,可在轉染開始之前更換新鮮的含血清培養基,以防轉染后孵育階段細胞密度太大、營養不足導致的細胞死亡。
2. 將步驟B制備的復合物滴加至培養基中。輕輕晃動培養皿以使復合物均勻分布。
3. 過夜培養24~48小時。
4. 注意:如果轉染后需要更換新鮮培養基,請于加入RFect/DNA復合物12~24小時后進行。培養基更換后,孵育24~48小時后再進行后續實驗。
5. 收獲細胞,進行后續實驗。
二、實驗準備及注意事項:
1. 細胞接種:一般做轉染前一天接種/鋪板(細胞計數參見說明書,細胞計數大約5*10^4cell/ml),使做轉染前細胞密度在30-50%;如果細胞是原代細胞,接種密度可以密一些,細胞計數在2*10^6cell/ml;懸浮細胞可以在轉染當天接種/鋪板(細胞計數大約5*10^4cell/ml),待細胞狀態穩定后做轉染前細胞密度30-40%。
2. 為了能在使用時有較好的轉染效果,第1次使用建議您用24孔板做,每孔1ug質粒,設置質粒轉染試劑2ul,3ul,4ul三個梯度,每個梯度做2-3個復孔(至少2個復孔,避免實驗誤差)。DNA 和轉染試劑的比例,通常推薦是1:2-1:3。轉染條件(質粒DNA與轉染試劑的用量、比例)放大到對應的孔板即可。
3. 用來稀釋siRNA和稀釋轉染試劑的培養基必須是無血清培養基,因為血清的存在會干擾DNA與轉染試劑的混合,并且影響轉染效率;
4. 檢測方法:轉染后48h收細胞做qPCR基因水平檢測或者轉染后72h收細胞提蛋白做western Blotting蛋白水平檢測。
三、質粒DNA轉染一般疑難問題及解決方法
1、低轉染效率:
1)轉染試劑與質粒DNA的比例不合
根據建議選用配比濃度,詳見下表。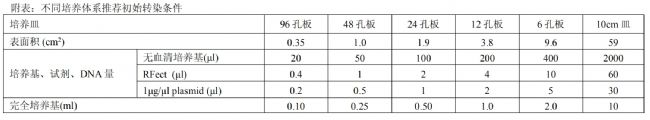
2)細胞狀態不佳,過密或過稀疏
細胞狀態不佳,細胞營養不良,細胞伸展不好,細胞密度稀疏,細胞過密都影響轉染效率。轉染前24小時左右對細胞進行轉接,接種密度約為每孔0.3~1×105個細胞即可。
3)抗生素損傷細胞
轉染培養基中含有抗生素會影響細胞轉染效率。因為轉染試劑相當于細胞打孔,這時培養基中存在抗生素則會進一步損傷細胞。
2.高細胞毒性:
1)質粒DNA受內毒素污染,或其他化學物質的污染
未使用去內毒素的質粒試劑盒提取質粒,對細胞損傷很大。轉染過程中會造成細胞死亡。
2)轉染后換液
使用傳統的轉染試劑,轉染后4-6小時必須進行換液,否則會由于轉染試劑毒性而引細胞死亡。本實驗所采用的RFect試劑盒在*培養基中具有很高的轉染效率,操作簡便,可用于含血清培養基培養細胞的轉染,轉染前后不需要更換培養液。
 您好, 歡迎來到化工儀器網
您好, 歡迎來到化工儀器網

 7
7