植物病理學是研究植物病害的病原、發生、發展以及防治的一門應用學科。它以植物病害為研究對象,探討發病的原因,或在解剖學、生理學或生物化學上,探討感染和癥狀出現的過程。為了確立防病和治病的方法,還研究形成病原的環境條件、病原體傳染途徑以及病害的診斷法等,另外還研究防病的藥劑對病原體或植物體的藥理作用,以及包括所有與植物病害有關的廣闊領域。多光譜成像系統是近年來出現的技術,可廣泛應用于植物病理學研究,利用丹麥Videometer公司生產的VideometerLab多光譜成像系統發表的文章多達數百篇,VideometerLab含19個多光譜波段以及可見光波段,同時實現光譜以及圖像成像。
中國的植物病理學是在生物學科中創建較早的一門學科,1917年就開始在高等農林教學中設置植物病理學課程。1929年中國植物病理學會成立,中國植物病理學會2019年學術年會暨學會成立90周年慶祝大會剛剛在成都舉辦。20世紀20~40年代,中國植物病理學戴芳瀾、鄧叔群、朱鳳美、俞大紱等在研究中國真菌形態和分類,各主要作物的真菌、細菌和病毒病害,以及抗病育種等方面做出了貢獻,在幾個高等農業院校和研究所中建立了研究室,培養了許多植物病理學工作者,為中國植物病理學的發展奠定了基礎。
當一株健全的植物受到干擾,導致器官和組織的生理機制局部的或系統的反常植物自身表現了病狀(symptom),并能從患病部位提取出的物質具有相應病原物的病征(sigh),就是發生了植物病害。干擾植物正常生理機制的因素,主要是外來的,內在的因子導致遺傳性病害;外來的因子有的是非生物性的,有的是生物性的。因此,根據誘發病害因子的本質,植物病害可分為非侵染性病害和侵染性病害兩大類。
植物在長期的進化歷程中,逐漸適應了各種不斷變化的環境,產生了較強的適應能力。但對各類環境因素的適應能力有一定限度,如果植物所處的環境中某些物理如光照、水分、溫度或化學因素如營養元素失調再貨生存環境發生惡化,連續不斷影響植物,其強度又較過植物忍耐限度,就會對植物的生長發育產生不利影響,擾亂正常生理和代謝活動,甚至對植物造成嚴重傷害,使植物在生理和外觀上表現異常,產生病變。
侵染性病害是植物病原物在外界條件影響下相互斗爭并導致植物生病的病害具有感染性。常見的植物病原體有真菌如黑粉病、銹病、白粉病等;卵菌如腐霉、霜霉等;原核生物以細菌為主如土壤桿菌、支原體、衣原體等;病毒如馬鈴薯Y病毒、黃征病毒、煙草花葉病毒等;高等植物如菟絲子、列當獨腳金等;原生動物如線蟲。其中以細菌、真菌、病毒、支原體和線蟲誘發的病害較普遍和嚴重,尤以真菌性病害為較,如水稻的瘟病、小麥銹病、棉花的萎蔫病等。各種病原體的生理、生態、增殖方法和生活史以及侵染寄主的方式、途徑和時期各不相同。
多光譜顯微表型成像系統是一套能夠實現微米級物體多光譜圖像采集的儀器,它不僅保持了顯微鏡對微小區域實時成像的特點,具備了采集該區域物體280~1050nm波段內光譜以及RGB融合圖像的能力,可普遍應用于微納光學、材料學、生物技術等領域。下圖為顯微光譜測量系統整機圖。

顯微光譜測量系統可分為三個模塊:照明模塊、光譜接收模塊以及成像模塊。照明模塊為10個-20個LED高功率光源組成,物體可獲得明亮且均勻的全場照明。光譜接收模塊以及成像模塊為CCD相機,在測量光譜的同時,可以實現物體圖像實時采集。
操作簡便:多光譜顯微表型成像系統同時具備多光譜測量和RGB測量功能模塊;該系統可實現對微小物體的區域選擇及定位(標配成像面積為3cmX3cm),分辨率可達1um/像素;測量能力強:具備傳統顯微鏡所不具備的顯微多光譜測量功能,傳統顯微鏡只能提供圖像的獲取,從而對物體進行形貌分析,該系統額外具備目前*表型成像技術,可對形態、尺寸等進行有效測量,獲得物體的顯微多光譜信息。多光譜顯微表型成像系統,在保有物體圖像采集的功能外,還可對物體進行不同區域光譜的采集與分析,較進一步的了解物體的紋理、結構與特性;擴展功能多:包含顯微尺度的透反射、熒光等顯微光譜測量,較大限度滿足各類的科研需求。
快速、無損檢測
包括處理在內每樣品處理僅需10-20秒
與其它破壞性技術組合
高靈活性測量
主要專注:可重復洗、可追溯性、耐用性、可傳遞性
顯微熒光標記檢測
VideometerMic多光譜顯微表型成像系統是一套突破性的多光譜成像系統。采用了少有的光譜成像檢測技術。在提高信噪比和多靶點標記的檢測方面,*克服了傳統成像技術的限制。可應用于植物、細胞、基因或蛋白芯片等研究領域,是一套功能強大的成像系統。該基礎模塊包括10個-20個散射波段,波長范圍為280-1050nm,攝像頭可固定或移動,集成的多光譜傳感器安裝在XYZ平臺上,實現30cmX30cm的樣品自聚焦和掃描,可測量較小的樣品,可用于擬南芥種子、細菌、真菌、蟲卵、細胞等成像。
VideometerMic多光譜顯微表型成像系統將傳統多光譜成像系統升級為多光譜成像系統。該系統具有強大熒光標記的檢測、分離和分析功能。在分析過程中,通過系統設置的激發光源組和內置在10-20位濾波輪中的一系列濾波器激發植物樣品中各種發色團的動態熒光。樣品激發出的熒光經顯微鏡放大后進行熒光光譜分析和成像分。
VideometerMic多光譜顯微表型成像系統是目前功能強大、全面的多光譜顯微表型成像系統,可以進行微藻、單個細胞、單個葉綠體甚至基粒-基質類囊體片段進行圖像熒光分析;還能通過激發光源組進行進行任意熒光激發和熒光釋放波段的測量,從而進行GFP、DAPI等熒光蛋白、熒光素以及藻青蛋白、藻紅蛋白、藻膽素等藻類*熒光色素的成像分析;較可以利用光譜儀對各種熒光進行光譜分析,區分各發色團。
VideometerMic多光譜顯微表型成像系統是一款跨越微觀與宏觀表型研究的系統,結合了顯微鏡和多光譜表型成像特征,使科研工作者在細胞和亞細胞層次深入理解植物生理表型,VideometerLab 4的所有表型工具均適用于該系統。
專有設計,實現微米級區域內的透反射光譜測量、熒光光譜測量。
反射顯微多光譜測量:通常使用系統高功率LED燈作為照明光源,對接收到的反射光進行采譜及分析。
透射顯微光譜測量:通常使用系統高功率LED燈作為照明光源,對接收到的透射光進行采譜及分析。
熒光顯微光譜測量:系統自帶濾波輪,進行熒光激發和分析。
系統放大可達40倍,可以清晰觀測到葉綠體及其發出的熒光,統計葉綠體數量等等。
激發光源組中包括紅光、藍光、綠光、白光、紫外光和遠紅光等,通過紅藍綠三色光還可以調出可見光譜中的任何一種色光,能夠研究植物體中任何一種色素分子或發色團。
高靈敏度CCD鏡頭
集成高分辨率多光譜能夠深入解析各種熒光的光譜圖。
熒光及明場多色標記應用領域;量子點探針的應用領域;分子病理學研究領域;植物學研究領域;植物病理學領域;表型性狀分析/挖掘,基因型-表型關聯;農業育種;園藝學、農業信息學;果實品質分析;植物病理研究;生物量分析;種子萌發研究;抗逆研究;植物應用領域;顯微結構的植物生理研究;植物逆境研究;生物和非生物脅迫的研究;植物抗脅迫能力及易感性研究;突變體篩選及光合機理研究;藻類長勢與產量評估;藻類*色素;植物—微生物交互作用研究;植物—原生動物交互作用研究;基因工程與分子生物學研究 ;測量植物樣品;花粉分析;植物活體切片;植物表皮;植物細胞;綠藻、藍藻等各種單細胞和多細胞微藻;葉綠體提取液;類囊體提取液;含有葉綠體的原生動物。
小麥是重要的作物之一,對全球食品安全至關重要。“Take-all "根病害是由子囊菌真菌Gaeumannomyces tritici(Gt)致病,可穿透根并毀壞維管系統。形成的黑色壞死斑破壞了養分和水吸收,導致減產達60%。其它密切相關子囊菌真菌品種,例如G. hyphopodioides(Gh),卻是對抗“take-all"病的生物控制劑。
G.hyphopodioides可侵染外皮質根層,但與“Take-all"不同,其不會侵入到中間部位,特征是在菌表面和亞皮下囊泡形成灰色菌絲。
來自英國的科學家研究重點是對高級成像技術進行評估,以對根定植進行真菌檢測和精確定量,通過測量光合參數評估對地上部健康的影響。研究中使用了VideometerLab 多光譜成像系統。

圖中顯示“Take-all"感染小麥幼苗。左側是原始圖像,有紅色箭頭標示“take-all "損失,用手工評分;右圖是相同圖像經‘VideometerLab’分析,將根組織分類為感病(藍色)和健康(桔色/黃色)。
具體實驗步驟:
A 5-week time-course seedling pot bioassay was set up using 250g of soil from Webb’s Field on the Rothamsted Farm, UK.
An artificial inoculum layer derived from PDA plates contained Gt, Gh or an uncolonised control. The pots were baited with 10 seeds of the wheat c*r‘Hereward’, and kept in a controlled environment room. Each week, the pots were visually assessed for the presence of necrotic lesions, greying and vesicles. The level of infection was recorded as the proportion of roots showing at least one area of fungal colonisation, making this a semi-quantitative method of assessment. Potentially, imaging could provide a more efficient method to assess root colonisation, allowing the affected root area to be accurately quantified and also removing the subjectivity that can be associated with manual scoring. Consequently, a key question was: can multispectral imaging be used to quantitatively assess and distinguish between Gt and Gh seedling root colonisation?
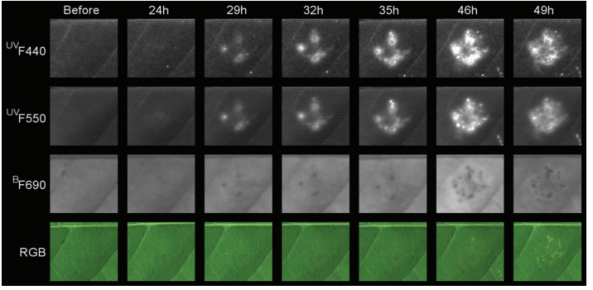
Multispectral imaging was accomplished using a ‘VideometerLab’ imager, a system that uses 19 different wavelengths ranging from UV to the NIR. Training images were taken of healthy roots, and those colonised with Gt or Gh. These training images were used to build statistical transformations, which were subsequently used to score pixels as corresponding to healthy or colonised root tissue. The threshold pixel score chosen ensured that, in the case of Take-all, only the dark black lesions were scored. The ‘VideometerLab’ and visual assessments of Take-all colonised roots showed a significant correlation (Spearman’s Rank, Rs = 0.670, p = <0.001, n =24). Interestingly, whilst low, the Take-all scores for the uninoculated, control plants, were consistently higher using the image-based scoring. It is possible that the ‘VideometerLab’ was detecting other fungal colonisation phenotypes caused by contamination in the soil which were not visible to the human eye. The ‘VideometerLab’ struggled to distinguish the root greying caused by Gh from mild Take-all symptoms and preliminary analysis has shown that the root greying phenotypes associated with the presence of both fungal species have similar pixel scores across all wavelengths. However, the dark necrotic Take-all lesions had a distinct spectral signature, supporting the validity of our method for scoring Take-all.
Prior to harvesting the roots for the imaging described above, a LemnaTec ‘PhenoCenter’ was used to evaluate the impact of fungal root colonisation on above ground plant health. Specifically, a PAM fluorescence camera was used to evaluate photosynthetic efficiency in the foliage. This technique is based on the observation that light energy absorbed by photosystem II can be dissipated via three routes: photochemical reactions, dissipated heat or as fluorescence – it’s the competition between these processes which is exploited to quantify photosynthetic parameters. While a small reduction in photosynthetic efficiency was observed for the Take-all infected plants, no significant difference was observed between the Gh and control pots. These are encouraging results as it would be undesirable for Gh to impact photosynthetic efficiency if used as a biocontrol agent.
藜麥(Chenopodium quinoa)是一種作物,營養豐富,在多個國家廣有種植。真菌病如霜霉病限制了谷物產量,培育抗性品系,如抗霜霉病品系是藜麥育種的中心目標。
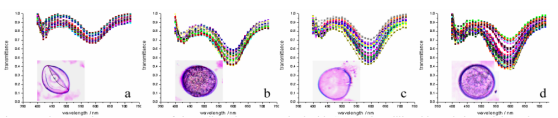
利用常規RGB成像來測量藜麥對霜霉病的表型反應(Peronospora variabilis ) 測量比較困難,原因在于來自不同藜麥基因型在葉片上有不同綠色和紅色斑點進行干擾,參見圖1和圖2。
開發圖像分析規程來區分健康藜麥葉片組織以及感染霜霉病的藜麥葉片組織。研究利用Videometer多光譜成像系統對嚴重度程度表型和孢子形成進行研究。
嚴重程度是葉片正面損傷的面積占整個葉片面積的百分比。依基因型不同,顏色可為桔色、黃色或紅色。
孢子形成是損傷部上方孢子量,以百分比測量,通過測量葉片正面進行評估。
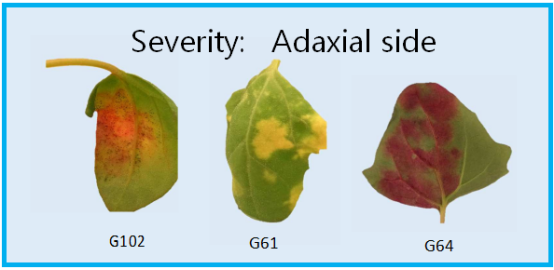
圖1 葉片正面嚴重度癥狀

圖2 葉片正面孢子形成
研究人員利用VideometerLab 4多光譜成像系統進行多光譜成像,積分球確保對樣品的均一照明(圖3)。每個獲取的圖像層由19個不同圖像波段組成,波長涵蓋365nm(UVA)到970nm(NIR)。圖像的每個像素分辨率為~41 µm。每個圖像層的分辨率為2192X2192像素。
從G9基因型葉片正面(圖4)清楚看到了黃化現象(A),拍攝了RGB圖像(常規相機,人眼可見光波段。(B)和(C)顯示了多光譜圖層中的2個波段,藍光490nm(B)和黃光570nm(C)。對健康植物組織和黃化界定進行了初始標記,轉換建立了模型(D),通過nCDA(歸一化典型判別分析將19個波段信息(圖像中多個圖層),轉換為了整個圖層的代表像素范圍值。之后切割(E和F),可用于所有圖像-所有品系和基因型,獲取有黃化組織(E黃色)百分比定量分析,該特定葉片比例為68.0%,或者包括紅色覆蓋孢子區(F),比例為18,9%,黃化(黃色)比例68%,孢子和黃化區綜合面積占比75.8%。
在葉片正面(底部),RGB圖像中的G9基因型清晰可見到孢子形成圖像(下底部A和B放大)。盡管在可見光波段很難檢測到單個波段,這里特別標出了藍光波段(490nm)(C)。進入NIR(780nm)波段(下左部的D和E放大),清晰看見了孢子。使用該信息(僅標識黑灰色孢子)可幫助我們區分切割孢子像素(F),并將該面積定量,該葉片孢子比例為12.5% (黃色顯示),不包括黃化部分面積。
另外,此處的孢子標識與正面圖像分析而言更加保守。 覆蓋的非黑灰區的像素部分 (像素比單個孢子要大)估計,孢子比例為~23%(此處未予以顯示)。

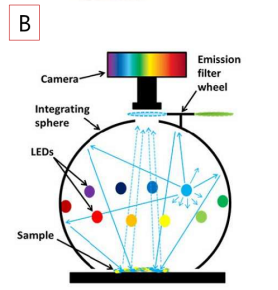
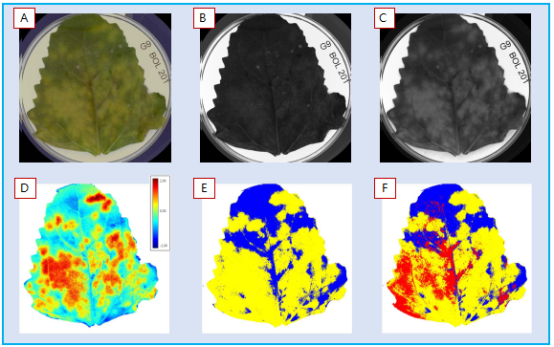
圖4(A) sRGB圖像。(B),490nm(藍光),(C),570nm(黃色),(D) 轉換,(E)和(F),2種類型定量分割。
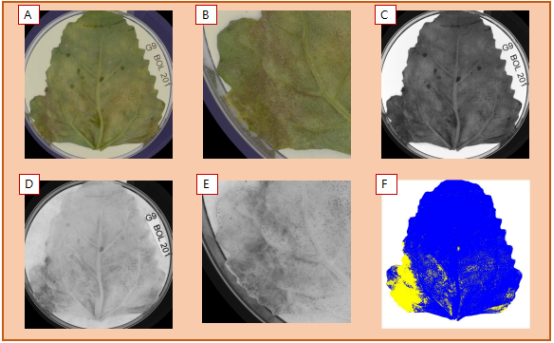
圖5(A) sRGB 圖像,(B)490nm(藍光),(C) 570nm(黃色),(D)轉換,(E)定量分割。
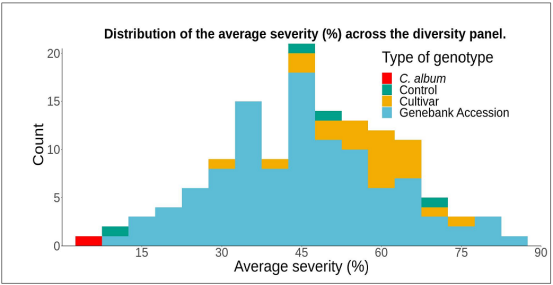
圖6:133個基因型的平均嚴重程度(%)分布
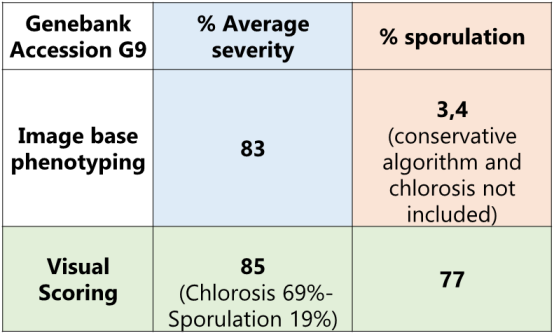
表1手工以及基于多光譜表型成像的藜麥霜霉病互作
研究對相關的132個藜麥基因型對霜霉病的表型反應進行了研究。設置了3個實驗,每個有4個區塊,配有復制控制樣品以及非復制基因型樣品。找到了對P. variablilis 反應變異大的藜麥基因型,發現了基因型對互作有著顯著影響 (p-value = 1.18 x 10-18) 圖6。研究人員對圖像表型研究結果進行了比較,研究人員正在開發適合覆蓋整個反應的算法。該綜述中,研究者展示了與G9基因型相對應的葉片圖像。結果總結在表1中,來不同區塊和試驗的分屬不同植株的10片葉子取了平均值。
多光譜成像如嚴格按照規程使用、記錄完善的話,是非常強勁的表型工具。對圖像定量基于算法應用,這需融合對疾病反應的經驗和知識。對孢子形成,菌絲萌發,滲透,侵染面積以及健康組織識別可提供更加近似的像素標識。
目前研究人員已經開發出了可應用于藜麥霜霉病互作的應用于損傷組織算法。
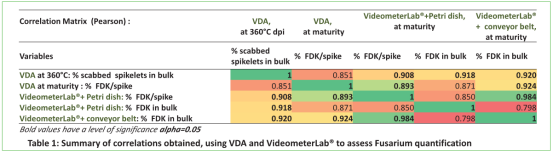
科學家開發了一種多光譜成像算法來評估小麥對鐮刀菌(F. graminearum and F. culmorum)的抗性。獲取結果與VDA方法視覺疾病評估)和qPCR方法進行了比較。研究目標是選擇新型、快速的表型方法來替換現有評價的VDA抗性評估方法。
視覺疾病評估方法與Videometer在不同生理階段對麥穗和群體的相關性(360-1050nm)
比RGB成像區分效果要好

VideometerLab® 以及傳送帶
2056x2056 像素/波段
1000粒種子掃描僅需5-10 min
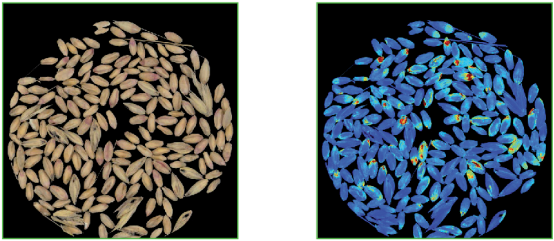
感染鐮刀菌小麥粒 CDA圖像
基于典型判別分析(CDA)分析感染麥粒(黃/紅),未感染 (藍色)
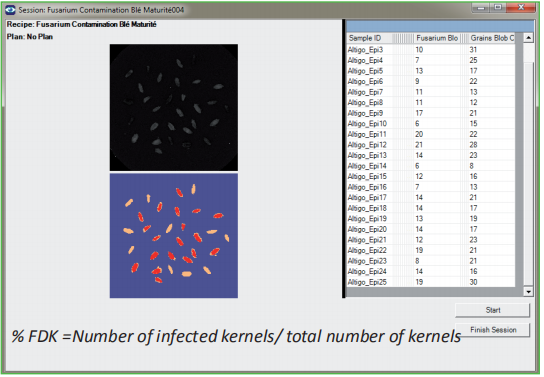
-分類像素的閾值化
-Excel 結果輸出
實驗設計:
- 噴灑接種:F.graminearum & F. culmorum
- 冬小麥: 5栽培種 (抗性控制)
- 25 麥穗(2個重復)(使用 VDA和 Videometer)
田間視覺評分:
360°C dpi : % 結痂小穗 ; % FDK
成熟 : % FDK
Videometer : % FDK
培養皿
-單穗:第1次重復25穗/cv
-散裝:≈從第2個重復的25個穗中收集1000粒/cv
傳送帶
?散裝≈從第二次重復的25個穗中收集1000粒/cv
qPCR
-5個品種≈第二次復制的1000粒/cv
-研磨每個品種的所有果仁,并從50 mg面粉中提取DNA
-具有特定TaqMan的qPCR® F.graminearum的探針
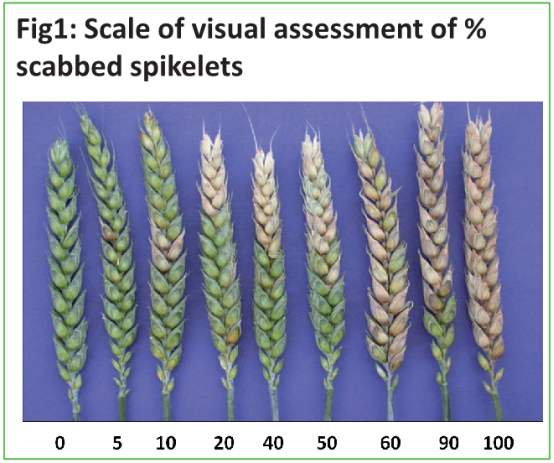
在不同生理期的不同個體麥穗和群體
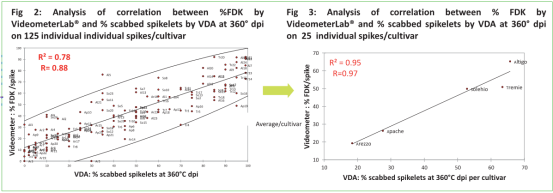
% 結痂麥穗s & % FDK
單個麥穗 &群體
? Videometer: 培養皿 & 傳送帶
? 360°C dpi評分 & 成熟
VDA (360°C麥穗和麥粒成熟) 與Videometer在麥粒成熟度上有很強相關性,以下模塊:
?單獨麥穗& 群體
? Videometer帶培養皿和傳送帶
在其它試驗中,用F. graminearum接種,觀察到了Microdochium spp自然侵染的微弱相關性。
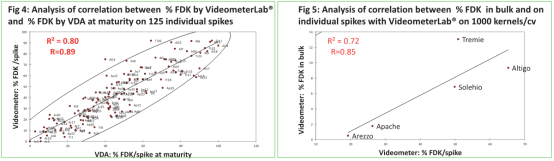
2.qPCR, VideometerLab® 和VDA的疾病評估相關性。
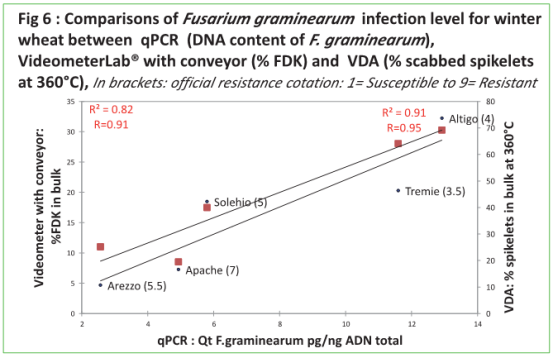
在qPCR 于帶傳送帶的Videometer 評估群體采集麥粒之間有高度相關性(R=0.91),qPCR與 VDA 在 360°Cdpi也有高度相關性(R=0.95),驗證了VideometerLab® 在成熟階段麥粒精確評估、快速定量鐮刀菌的能力,這與抗性分類相一致。
使用VideometerLab®集合開發算法,在評價感染鐮刀菌(Fusarium graminearum)和culmorum 的抗性時取得了很好的結果。更多時間將在更多品系小麥以及谷物上進行。針對該應用還可開發更多的算法。
立即詢價
您提交后,專屬客服將第一時間為您服務