目錄:和元李記(上海)生物技術有限公司>>細胞生物學>>支原體檢測與祛除>> AC16L062Quick Cell 發光法支原體檢測試劑盒
| CAS | / | 純度 | / |
|---|---|---|---|
| 分子量 | / | 分子式 | / |
| 供貨周期 | 現貨 | 規格 | 50 T |
| 貨號 | AC16L062 | 應用領域 | 生物產業 |
產品描述
Quick Cell發光法支原體檢測試劑盒,通過檢測支原體的特異性酶活性以達到檢測體外培養的哺乳動物細胞是否被支原體污染的目的。
在支原體裂解后,該支原體特異性的酶,在底物存在下,具有將ADP轉化成ATP的功能。由于熒光素酶(Luciferase)催化底物熒光素(Luciferin)產生光的反應需要ATP的參與,支原體特異性酶催化產生的ATP含量,可以通過該反應轉化成生物發光(Bioluminescence)信號,該信號可以使用專門的發光檢測儀(Luminometer)或具有發光檢測功能的多功能酶標儀進行檢測,發光的強度與ATP的含量成正比。通過比較細胞培養上清和未用于細胞培養的培養液上清二者的支原體特異性酶的含量,即可知道培養的細胞是否被支原體污染。反應原理如下: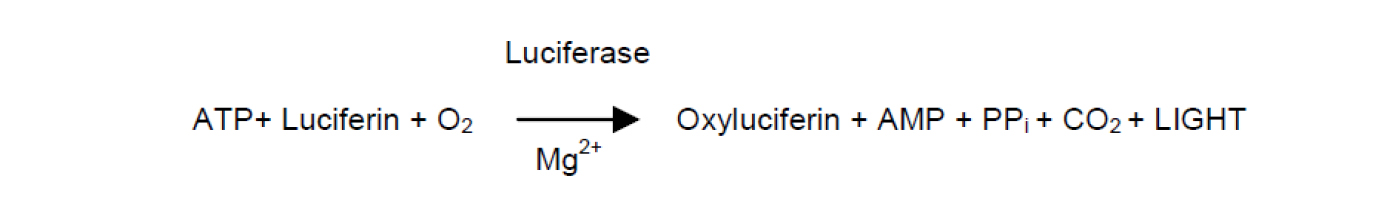
訂購信息
| 產品名稱 | 產品貨號 | 規格 | 價格 |
| Quick Cell 發光法支原體檢測試劑盒 | AC16L062 | 50 T | 1680 |
運輸與保存
干冰運輸。-20℃短期保存,-80℃長期保存;有效期60個月。
使用方法
1.檢測試劑的準備
產品從-80 ℃冰箱取出,在冰上操作,*使用,分別用2.5 mL支原體檢測溶液溶解試劑A和試劑B(注:因為試劑 A 和試劑 B 的離心管容量不足2.5 mL,可以分別先用1 mL 支原體檢測溶液將凍干的試劑 A 和試劑 B 溶解后,轉移到一個5 mL 或10 mL 的離心管中,再各補加1.5 mL 支原體檢測溶液)。按每管50 μL可分別分裝到50個1.5 mL離心管中,根據待檢測的樣品數量及陰性對照數量確定A、B試劑的用量(不用的試劑放置于-80 ℃冰箱低溫保存,隨用隨取)。試劑A和試劑B,放室溫5 min左右(注:不能加熱),等其熔解后放冰上待用。
【注】:試劑 A 和試劑 B 只能在每次檢測之前從-80 ℃冰箱取出的,熔解后在室溫放置的時間盡可能的短,不能超過20 min。熔解后,放冰上的時間也不能超2 h。已經融化后的試劑 A 和試劑 B 不能再次凍存使用。
2.陰性對照的設置
本試劑盒每次檢測都必須設置陰性對照。陰性對照除了沒有培養細胞外其他成分*相同,包括其中的血清批次、含量、抗生素等含量也必須*相同。陰性對照配制完后放于4℃冰箱。如果有些樣品實在沒有合適的陰性對照或者不知道樣品原來的培養基組成,可以嘗試使用含10%血清的 DMEM 培養基作為陰性對照。
3.陽性對照的設置
可用已經檢測含有支原體污染的樣品作為陽性對照。
4.待測樣品的準備
為了準確判斷細胞是否有支原體的污染,具體操作如下(請嚴格按照相應的體積進行操作):
(1)貼壁細胞待測的細胞培養3 d且匯合度在70-90%左右時,取180μL-1500μL培養液上清,在普通臺式離心機上150 g (大約1000 rpm )低速離心 5 min,準確吸取離心后的上清到一個新的1.5 mL離心管內,丟棄含細胞沉淀的原有離心管。懸浮培養的細胞需要在換液傳代后,至少讓細胞生長3 d再取培養液進行上述操作。
【注1】:離心力要嚴格控制在150 g左右,該離心力下,哺乳動物細胞將被沉淀下來而支原體不會。更高的離心力將可能導致支原體也被離心下來,從而導致假陰性。而更低的離心力將可能導致哺乳動物細胞不能被離心沉淀下來,從而導致支原體經測時,哺乳動物細胞內的ATP也被釋放到溶液中,從而導致假陽性。
【注2】:待測細胞上清樣品越多,越有利于支原體污染濃縮富集,1500μL培養液上清,經后續處理后,支原體濃度提高10倍左右。
【注3】:制備好的待測樣品如果不是當天立即檢測,放于-80℃冰箱保存,不得放于室溫、4 ℃或-20 ℃冰箱,樣品在-80℃可以保存1 年;為了日后檢測方便,應該同時凍存一些作為陰性對照的培養液。
(2)將含有上清的1.5 mL離心管,在臺式離心機上16000 g(大約13000 rpm)高速離心5 min,棄去上清。
【注】:切勿讓吸頭碰到離心管底部,底部為可能含有支原體的沉淀。往離心管內,加入120 μ*期配好的陰性對照培養液。
(3)將上述經過離心清洗一次的樣品,再次在普通臺式離心機上16000 g(大約 13000 rpm)高速離心 5 min,同樣小心吸走離心后的上清并丟棄。
【注】:同樣勿讓吸頭碰到離心管內壁的底部外側。留下大約5 μL培養液的目的也是為了防止吸頭碰到離心管底部外側而將可能含有支原體的沉淀吸走;注意離心管放置方向與上一次離心時相同。
(4)向上述經過兩次離心清洗的樣品中加入115 μL陰性對照的培養液,用移液槍上下吹吸10-20 次,將可能含有支原體的沉淀吹打均勻,用于后續支原體檢測(夠兩次檢測使用)。此時,總體積仍然約為120 μL)。
【注】:將培養液替換成陰性對照的培養液是為了排除一些細胞代謝產物對后續檢測的可能干擾。
5.支原體樣品檢測
(1)將溶解后的試劑 A、試劑 B放冰上融化(注意:不能加熱),試劑A和試劑B融化后立即用于檢測。試劑A、試劑B融化1 h后,檢測靈敏度開始顯著降低,試劑 A和試劑 B融化后不能反復凍融使用。
(2)吸取50 μL陰性對照、陽性對照和待測樣品,分別移入不透明(白色或者黑色均可)的96孔板內,加入50 μL冰上放置的試劑 A,室溫反應 15 min。
【注】:不能使用透明的 96 孔板,否則孔與孔之間的發光值會互相干擾。
(3)吸取50 μL冰上放置的試劑B,加入到已反應15 min的上述反應液中,立即在多功能酶標儀或者發光檢測儀(Luminometer)上,以儀器默認的螢火蟲熒光素酶(Luciferase)的發光檢測參數的參數進行發光值的檢測,5 min內,連續測5次陰性對照和待測樣品的發光值,計算各自的平均值。
【注1】:發光檢測(Luminescence)與熒光檢測(Fluorescence)、吸收光檢測(Absorbtance)是不同的功能。吸收光檢測即常用的 OD 值檢測。熒光檢測(比如常見的 FITC 檢測)需要激發光,而發光檢測(如熒光素酶的活性檢測)不需要激發光。多功能酶標儀常見的檢測功能有:吸收光檢測、熒光檢測和發光檢測,三種功能為獨立的功能。您如果不清楚您實驗室的酶標儀是否具有發光檢測功能,請咨詢您的實驗室主任或者酶標儀廠家。
【注2】:發光檢測時,應該選擇不加載任何濾光片(不同酶標儀表達方式不一樣,可能是:Unfiltered LUM、All wavelengths 或 Open hole)進行檢測(此時讀值較高)或者使用螢火蟲熒光素酶(Luciferase)峰值的發光波長560 nm進行檢測(此時讀值較低)。
【注3】:可以通過調節酶標儀的檢測靈敏度(Sensitivity)或延長發光檢測的時間(Integration time,Measurement time),盡量讓陰性對照的發光值大于 1000。
【注4】:如果樣品是無血清細胞培養上清,相應的陰性對照培養基因不含血清,其發光值可能會比較低, 甚至只有 100 左右的發光值,此時可以在陰性對照培養基中加入10%的胎牛血清或小牛血清,當然無血清細胞上清樣品也必須用含10%的胎牛血清或小牛血清的陰性對照培養基進行替換(高速離心后替換,見上述步驟4)后,再進行檢測。加入血清后一般可以明顯提高陰性對照的發光值。
6.結果判斷
計算待測樣品的發光平均值與陰性對照的發光平均值的比值:
(1)如果比值>1.2,說明待測樣品有支原體污染(陽性)。嚴重的污染該比值可以達到10以上。
(2)如果比值在1.1-1.2之間,說明待測樣品可疑有支原體污染(可疑陽性)。該樣品需要繼續培養24-48小時后,重新檢測。如果繼續培養24-48小時后,重新檢測的比值仍然在1.1-1.2之間,應該判為陰性。
(3)如果比值<1.1,說明待測樣品無支原體污染(陰性)。
表1:本試劑盒產品優勢
| 比較內容 | 支原體檢測PCR法 | Quick Cell發光法支原體檢測試劑盒 |
| 操作時間 | 3小時 | 0.5小時 |
| 是否需要樣品處理 | 樣品處理,DNA提取 | 無需樣品處理,直接使用上清 |
| 區分支原體活性 | 檢測DNA,不能區分支原體死活 | 檢測支原體蛋白,檢出活性支原體 |
| 是否需要電泳 | 需要電泳及染色 | 不需電泳,結果目測 |
| 假陽性、假陰性可能 | 有 | 無 |
產品圖片

相關試劑推薦
EZ Cell Transfection Reagent(EZ Trans細胞轉染試劑)(貨號:AC04L092)
特優級胎牛血清(extra-special FBS)(貨號:AC03L035 )