詳細介紹
 SDS-PAGE分離不同磷酸化水平的蛋白!
SDS-PAGE分離不同磷酸化水平的蛋白!
在不使用放射性同位素的情況下,利用Phos-tag™ SDS-PAGE即可分離不同條帶中的磷酸化和非磷酸化蛋白。分離后的凝膠可用于蛋白質印跡和質譜分析等后續實驗。
Phos-tag™ SDS-PAGE操作簡單,只需在常規SDS-PAGE膠中加入Phos-tag™ Acrylamide 和二價錳離子或者鋅離子即可進行實驗。在電泳過程中,磷酸化蛋白的磷酸基團與Phos-tag™中的二價金屬離子相結合,降低其遷移速度,從而可區分磷酸化與非磷酸化蛋白。
◆原理
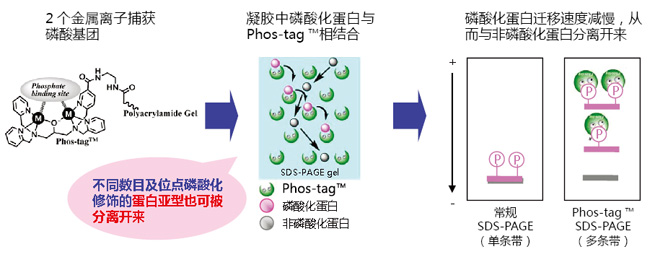
◆優點、特色
● 采用Phos-tag™ SDS-PAGE可輕松分離磷酸化蛋白
無任何放射性元素及化學標記!
● 可檢測不同磷酸化水平的磷酸化蛋白
無需任何磷酸化抗體!
● 適用于內源性蛋白的磷酸化分析!
◆案例、應用


【使用Phos-tag™ SDS-PAGE的磷酸化/非磷酸化蛋白比較】
我推薦使用Phos-tag ™ ——東京大學研究院醫學研究科 小川覺之
Phos-tag ™ 是專為研究磷酸化蛋白而新開發出來的試劑。此產品使用方便,不但可用于體外實驗,還能定量分析體內蛋白的磷酸化水平。可用于常規電泳實驗,無需購買特殊設備,性價比高。傳統蛋白磷酸化的研究需要特異的磷酸化抗體、RI 等其它試劑,操作復雜,花費大,且放射性元素會有安全隱患,而Phos-tag ™ 的出現恰恰可以彌補這些缺點,為磷酸化蛋白研究提供新的方向。
磷酸化蛋白和非磷酸化蛋白利用Phos-tag ™ SDS-PAGE 的分離效果圖

Lane 1 為非磷酸化蛋白,Lane 2-5 為磷酸化蛋白,各蛋白因磷酸化狀態不同而條帶遷移率也有所不同。
磷酸化/ 非磷酸化蛋白的數量比、磷酸化程度、磷酸化蛋白的豐度等都可根據條帶遷移和條帶濃度求得。
【資料提供】
日本東京大學研究生院醫學系研究科
【二維電泳中的應用:分析hnRNP K 磷酸化異構體】
小鼠巨噬細胞J774.1 經LPS 刺激后,裂解細胞,經過免疫沉淀法分離得到hnRNP K。在二維電泳中,一維是IPG 膠,二維是Phos-tag ™ SDS-PAGE,可分離hnRNP K 的異構體。利用質譜儀,可以確認不同的點代表不同的亞型或修飾蛋白。
二維電泳

同一個等電點的位置上,不同位點發生磷酸化都可以被區分開來(例: spots 6 vs. 8 and spots 4 vs. 7)
【結果提供】
橫濱市立大學 生命納米系統科學研究科 生物體超分子系統科學專業 木村彌生、平野久理化學研究所RCAI 小原收
【EGF 刺激前后MAPK 磷酸化水平的變化】
常規SDS-PAGE 和Phos-tagTM SDS-PAGE 后迚行克疫印跡實驗分析EGF 刺激的A431 細胞中MAPK 磷酸化水平。

SDS-PAGE分離不同磷酸化水平的蛋白
1. Phos-tag® Acrylamide的溶解
5 mmmol/ Phos-tag® 液體 (3v/v% 甲醇):
1)10 毫克 Phos-tag® Acrylamide 里加入 0.1 毫升 甲醇
2)使用槍頭攪拌混合直至*溶解。
3) 加3.2 毫升 蒸餾水, 用槍頭混勻。
2-8℃避光保存。不適合零度以下保存。建議保存時間6個月。
注意:避免溶解過程出現白色懸浮顆粒。
2. α-Casein, from Bovine Milk, Dephosphorylated(038-23221),陽性對照(含有磷酸化和非磷酸化α-Casein),如何使用?
用水或者上樣buffer溶解。用水溶解后,冷凍保存。電泳條件:Phos-tag® 50 umol/L,分離膠濃度 10%。
電流:30 mM,1小時。
3. 用Alkaline Phosphatase(for Biochemistry)(018-10693)進行磷酸化蛋白的去磷酸化反應體系。
37℃,過夜。# 10 mg/mL phosphorylated protein 50 微升
# 0.50 M Tris/HCl buffer (pH 9.0) containing 0.10 M MgCl2 10 微升
# Sterilized water 39 微升
# Alkaline phosphatase(018-10693). 0.3 unit / 1 μL有一點需要注意:ALP活性化使用Mg離子,相同的非磷酸化蛋白質用ALP處理的樣品的條帶和沒有用ALP處理的樣品的條帶的位置不同。
4. Phos-tag® SDS-PAGE實驗沒有成功分離磷酸化蛋白:
1)使用α-Casein, from Bovine Milk, Dephosphorylated(038-23221)作為陽性對照,確認實驗條件和試劑均沒有問題。
2)可使用Phos-tag® Biotin檢測樣品中是否有磷酸化蛋白。確認有磷酸化蛋白后,再通過Phos-tag® SDS-PAGE進行分離鑒定。
3)經質譜鑒定有表達磷酸化蛋白,建議增大樣品的含量,可使用Phos-tag® Agarose進行磷酸化蛋白的富集。磷酸化蛋白含量過低,會影響其分離效果。
4)文獻報道有表達磷酸化蛋白,或者同源蛋白有表達磷酸化蛋白的,建議用Phos-tag® Biotin先確認 樣品中是否有磷酸化蛋白。
5)建議樣品的pH值在7左右。酸性或者堿性條件下,二價錳離子 -Phos-tag® 與磷酸化基團的特異性結合較差。
6)避免樣品中含有高濃度的還原劑,變性劑,表面活性劑等。β-巰基乙醇濃度不高于0.2 M(或者5%)。
7)進行Phos-tag® SDS-PAGE的合適樣品是純化的蛋白。如果是細胞裂解液,體外激酶反應液,組織均漿液等,需要摸索合適的分離膠,Phos-tag® Acylamide的濃度。建議Phos-tag® Acrylamide濃度從50 μM開始摸索。
5. Phos-tag® SDS-PAGE凝膠用于Western Blotting實驗的優化建議:
1)可以檢測的樣品包括體外激酶反應體系,細胞裂解液,組織均漿液。
2) 每孔樣品的上樣量是10~30 微克(請根據蛋白表達量進行調整)
3) 制備樣品中含有的還原劑、變性劑、螯合劑、釩酸等會使電泳條帶發生彎曲或者拖尾。通過TCA沉淀或滲析法降低雜質含量。
4)建議樣品的pH值在7左右。如果加入上樣緩沖液后溶液顯黃色或者橙色,加入Tris緩沖液調整pH值為7。
5)目的蛋白分子量大于60 kDa,分離膠的丙烯酰胺濃度為6%;目的蛋白分子量小于60 kDa,分離膠的丙烯酰胺濃度為8%。
6)如果樣品中含有大量蛋白,比如細胞裂解液,組織均漿液,Phos-tag®乙酰胺濃度為5~25 uM。若目的蛋白濃度低,建議Phos-tag® 乙酰胺濃度為100 uM。
7)Phos-tag® SDS-PAGE凝膠用于Western Blotting實驗,濕法轉膜建議:10 mM EDTA的轉移緩沖液處理凝膠10 分鐘,不含有EDTA的轉移緩沖液處理凝膠10 分鐘。重復3次。強烈建議濕法轉膜
8)Phos-tag® SDS PAGE半干法轉膜建議:
i.電泳后用含有EDTA的轉移緩沖液處理凝膠,EDTA的濃度為 100 mM。100 mM EDTA的轉移緩沖液處理凝膠10 分鐘,不含有EDTA的轉移緩沖液處理凝膠10 分鐘。重復3次。
ii.轉膜的電流值提高2%~3%, 延長時間2成。
iii.轉膜的緩沖液加SDS,加到大約0.05~0.2%,轉膜效率會提高。
9)使用目的蛋白的非磷酸化抗體即可。比如檢測各種腫瘤細胞系中Src激酶活性實驗,用Src的非磷酸化抗體即可。
10)和光的WIDE-VIEW™ Prestained Protein Siza MarkerIII(230-02461)可檢測作為轉膜效率,但是無法判斷分子量。
11)一般預染的蛋白marker在Phos-tag® SDS-PAGE中條帶會彎曲,無法判斷蛋白分子量。
12)不能確認磷酸化蛋白和非磷酸化蛋白的分離,請進行常規的SDS-PAGE,Western Blotting實驗。比對目的蛋白的遷移率。
13)不能確認是因為蛋白發生磷酸化還是出現降解造成蛋白條帶遷移,請進行常規的SDS-PAGE實驗,確認不會出現條帶遷移。
14)目的蛋白磷酸化與非磷酸化分離效果不佳,使用α-Casein, from Bovine Milk, Dephosphorylated(038-23221)作為陽性對照,確認實驗條件和試劑均沒有問題。如果確認能夠分離,調整分離膠, Phos-tag® Acylamide的濃度。建議使用品質佳的氯化錳(139-00722)。
 化工儀器網
化工儀器網





 化工儀器網
化工儀器網