當前位置:迪圖(上海)生物科技有限公司>>技術文章>>熒光定量pcr儀定量方法之-定量
在做qPCR實驗時,我們經常會問:“你是做定量還是相對定量呢?”,而定量方法的選擇是取決于實驗的目標。定量可測定目標核酸分子的實際拷貝數,但也是費力、復雜的定量形式。此方法要求周密的實驗方案和高度準確的標準曲線,常用于確定病毒滴度。
使用標準曲線進行定量
定量是通過樣品的Cq值和標準曲線進行比較實現的。首先為了建立標準曲線,需要已知拷貝數濃度的標準品,對標準品進行5次以上的連續梯度稀釋,將稀釋的標準品進行實時熒光定量PCR擴增,后根據各樣品的拷貝數濃度及相應的Cq值繪制標準曲線,得到線性方程Cq= -klgX0+b,其中X0為起始模板量。然后將未知樣本的Cq值與此標準曲線進行比較,確定其拷貝數濃度。
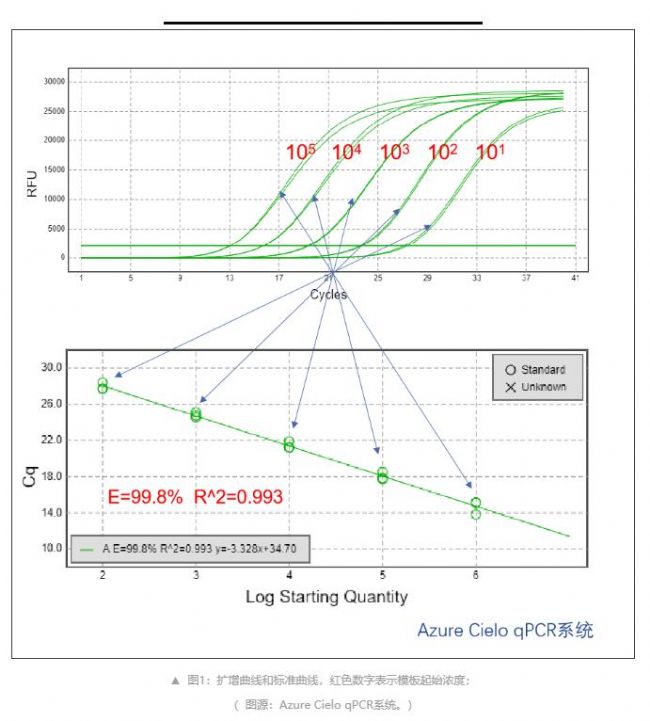
從圖1可以發現,當模板起始濃度越大時,熒光達到閾值的循環數越少,即Cq值越小。反之,模板起始濃度越小時,Cq值越大。起始模板量的Log值與循環數Cq值呈線性關系,通過已知起始拷貝數的標準品作出標準曲線,即可確定未知待測樣本中目的基因的量。
如何選擇標準品?
如前所述,生成標準曲線采用的模板將決定數據的準確度。所以使用與實驗樣本盡可能類似的目標模板,可優選有證的標準物質或參考物質。那么制備標準品的常見方法如下:
? DNA 標準品:目的靶點的PCR擴增片段或含有目的靶點的質粒克隆(圖2)。
優點:易于生成、定量,可在適當的儲存條件下維持穩定性。
缺點:無法進行qRT-PCR 的逆轉錄步驟,大大影響了反應效率。
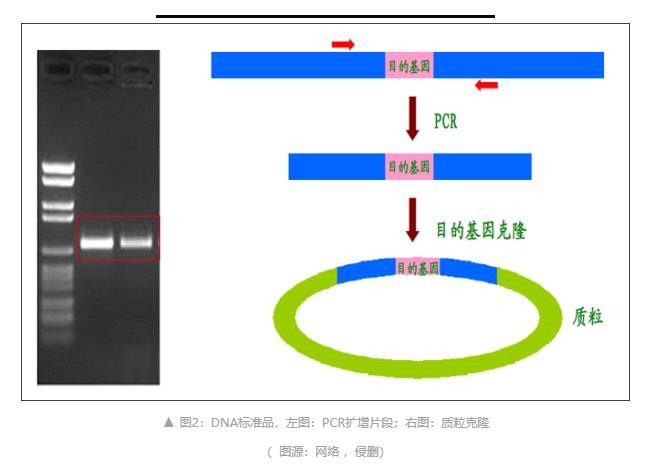
PCR擴增片段:通過常規PCR進行目的片段擴增,回收純化PCR擴增片段,可直接作為標準品,相對于質粒,PCR擴增片段不是那么穩定。
質粒克隆:將目的片段進行PCR擴增,回收目的條帶后連入T載體,再進行質粒提取,OD值定量,將質粒梯度稀釋作為標準品使用。
? RNA 標準品:目的靶點的體外轉錄RNA(圖3)
優點:結合了RT效率,程度地模擬了目的靶點。
缺點:需要耗費時間生成該標準品,因其不穩定,難以保持長期準確度。
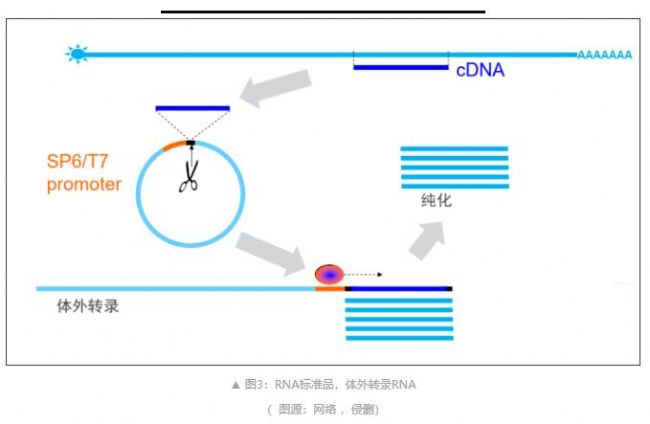
體外轉錄RNA:利用實時熒光定量PCR生成的PCR 產物可利用包含5’ T7啟動子的序列和包含 3’ poly(T) 的逆轉錄引物重新擴增。體外轉錄反應生成多聚腺苷酸化正義mRNA。純化后可將其準確定量并稀釋,用于生成標準曲線。
Azure Cielo™實時熒光定量PCR系統——定量示例
•方法:從組織中提取基因組DNA,以TaqMan探針法進行熒光定量檢測
•試劑:PerfeCTa qPCR ToughMix UNG(QuantaBio)
請輸入賬號
請輸入密碼
請輸驗證碼
以上信息由企業自行提供,信息內容的真實性、準確性和合法性由相關企業負責,化工儀器網對此不承擔任何保證責任。
溫馨提示:為規避購買風險,建議您在購買產品前務必確認供應商資質及產品質量。