薄膜過濾法微生物限度檢查CYW-300S
| 參考價 | ¥ 6800 | ¥ 6400 |
| 訂貨量 | 1-4臺 | ≥5臺 |
- 公司名稱 杭州川一實驗儀器有限公司
- 品牌 川一儀器
- 型號
- 產地
- 廠商性質 生產廠家
- 更新時間 2024/7/26 8:14:20
- 訪問次數 809
聯系方式:倪經理19032291360 查看聯系方式
聯系我們時請說明是化工儀器網上看到的信息,謝謝!
| 產地類別 | 國產 | 價格區間 | 1-2萬 |
|---|---|---|---|
| 應用領域 | 環保,食品,化工,制藥,綜合 |
薄膜過濾法微生物限度檢查CYW-300S主要特征:
1.一體化超小型設計,減小了對層流臺操作空間的占用。
2. 濾膜預先滅菌,即拆即用,可將主要污染物源降低,提高檢測可靠性
3.過濾杯采用唇形密封設計,不使用夾鉗和 O 型圈,確保無泄 漏操作和均勻的微生物回收率
4.可同時抽濾多張濾膜,大大提高了工作效率。
5.濾杯采用可重復使用材料設計,經久耐用,節省成本,操作方便。
6.每個濾頭采用獨立控制的方式,方便操作人員靈活使用。
7.無油真空泵設計,噪音低。
8.儀器表面經鏡面處理,便于清潔和消毒。
9.過濾頭可以火焰快速滅菌,方便連續實驗操作;
10.已氧化的美觀的把手分布基座兩端,使其更加穩固;
11.穩固的低重心設計使其不會因溶液滿載而發生翻倒。
薄膜過濾法微生物限度檢查CYW-300S技術參數:
1、適用濾膜直徑:Φ47mm/50mm;
2、有效過濾直徑:40mm;
3、濾杯容量:150ML(250ml 可選);
3、過濾頭數量:1/3/6 ;
4、檢測方法:薄膜過濾法;
5、抽濾方式:隔膜泵負壓抽濾,無需抽氣瓶;
6、抽液速率:100ml/15s;
7、過濾頭滅菌方式:濕熱滅菌
8、濾頭:可拆裝。

微生物限度檢查方法(薄膜過濾法)
驗證方案
微生物限度檢查方法(薄膜過濾法) 驗證方案
編碼:表
一、驗證方案的起草與批準
1.驗證方案起草
起草人: 起草時期: 年 月 日
2.驗證小組成員:
3.驗證方案審核
4.驗證方案批準
批準人: 批準日期:
二、驗證方案
1.驗證目的和原理
1.1驗證目的
為確認所采用的方法適合于該藥品的細菌、霉菌、酵母菌數的測定,特制定本方案。驗證過程應嚴格按照本方案規定的內容進行,若因特殊原因確需要變更時,應報驗證委員會批準。
1.2原理
通過比較試驗4組中試驗菌的恢復生長結果來評價整個檢驗方法的準確性、有效性和重現性。
2.驗證方法步驟
2.1驗證前的準備:進行微生物限度檢查方法(薄膜過濾法)驗證前,所有的平皿和稀釋劑都應該嚴格
按照相關的滅菌程序消毒,以確保其對試驗的結果沒有影響。試驗菌應包括G—、G+、酵母菌和霉菌類微生物以基本覆蓋樣品中可能存在的微生物。
2.2驗證試驗的操作計劃:用3個不同批號產品微生物限度檢測方法進行平行試驗,通過計算回收率來判斷限度檢查方法是否對產品有影響。
2.3試驗結果可接受標準:用標準菌株評價方法“ ”的微生物限度檢查對檢品中微生物的抑制性,試驗結果應顯示3次獨立的平行試驗中,稀釋劑對照組的菌回收率應不小于70%,試驗組回收率也不低于70%。
3.試驗實施
3.1試驗前的準備
3.1.1主要儀器設備:恒溫培養箱、生化培養箱、電子天平、高壓蒸汽滅菌器、凈化工作臺。
3.1.2操作環境:操作間應該安裝空氣除菌過濾層裝置。環境潔凈度不應低于10000級,局部潔凈度為100級(或放置同等級凈化工作臺)。操作間或凈化工作臺的潔凈空氣應該保持對環境形成正壓,不低于4.9pa。
3.1.3試驗樣品:
批號: 批號: 批號:
3.1.4培養基:
3.1.5稀釋液:PH7.0無菌氯化鈉-蛋白胨緩沖液
以上經115℃高壓蒸汽滅菌30min。
3.1.6驗證用微生物名稱及其編號
實驗菌株的來源:
編號由菌名首字母—傳代代數—制備日期組成。
3.1.7器具:無菌薄膜過濾器:(孔徑0.45um直徑50mm)、無菌移液管(5ml)
4.驗證方法
4.1菌液的制備
將大腸埃希菌、枯草芽孢桿菌接種至10ml的無菌營養肉湯中在30~35℃下培養18~24小時,將白色念珠菌接種至改良馬丁液體培養基中,在23~28℃下培養24~48小時。將黑曲霉接種至改良馬丁液體培養基中,在23~28℃下培養5~7天。將上述培養物用0.9%的無菌氯化鈉溶液制成每1ml含菌落數為50~100cfu的菌懸液。
4.2實驗方法
供試液的制備:取樣品10g(ml)加入無菌PH7.0氯化鈉-蛋白胨緩沖液100ml,振搖使分散均勻□,用勻漿儀混勻□,置45℃水浴使膠囊殼溶化混勻□,制成1:10均勻的供試液。
A樣品試驗組
取1:10供試液(相當1g或1ml供試品)10ml,加至100ml稀釋液中混勻,過濾并用稀釋液沖洗濾膜3次,每次100ml,在*后一次沖洗液中加入50~100cfu菌液,濾完后,將接有細菌的濾膜取出,菌面向上(接觸細菌和樣品的面)貼于已凝固的培養基上。大腸埃希菌、枯草芽孢桿菌貼于營養瓊脂培養基平皿上;白色念珠菌、黑曲霉貼于玫瑰紅鈉瓊脂培養基平皿上。
B菌液組
取上述制備菌液各1ml加至100ml稀釋液中混勻,過濾并用稀釋液沖洗濾膜3次,每次100ml,濾完后,將接有細菌的濾膜取出,菌面向上(接觸細菌和樣品的面)貼于已凝固的培養基上。大腸埃希菌、枯草芽孢桿菌貼于營養瓊脂培養基平皿上;白色念珠菌、黑曲霉貼于玫瑰紅鈉瓊脂培養基平皿上。
C供試品對照組
取上述1:10供試液10ml,加至100ml稀釋液中混勻,過濾并用稀釋液沖洗濾膜3次,每次100ml,濾完后,將濾膜取出,接觸樣品的面向上貼于已凝固的培養基上。大腸埃希菌、枯草芽孢桿菌貼于營養瓊脂培養基平皿上;白色念珠菌、黑曲霉貼于玫瑰紅鈉瓊脂培養基平皿上。
D稀釋劑對照組
取PH7.0氯化鈉-蛋白胨緩沖液沖洗濾膜3次,每次100ml,在*后一次沖洗液中加入50~100cfu菌液,濾完后,將接有細菌的濾膜取出,菌面向上貼于已凝固的培養基上。大腸埃希菌、枯草芽孢桿菌貼于營養瓊脂培養基平皿上;白色念珠菌、黑曲霉貼于玫瑰紅鈉瓊脂培養基平皿上。
4.3培養
將大腸埃希菌、枯草芽孢桿菌在30~35℃下培養48小時,將白色念珠菌、黑曲霉在23~28℃下培養72小時,點計菌落數。
5.試驗結果
5.1產品試驗組微生物生長檢查情況: 批號:
5.2供試品對照組微生物生長檢查情況: 批號:
5.3稀釋劑對照組微生物生長檢查情況: 批號:
5.4菌液組微生物生長檢查情況: 批號:
6.回收率計算
6.1稀釋劑對照組菌回收率
表中:回收率=稀釋劑對照組的平均菌落數÷菌液組的平均菌落數×100%。
6.2試驗組菌回收率
表中:回收率=(試驗組的平均菌落數-供試品對照組的平均菌落數)÷菌液組的平均菌落數×100%。
7.結論:
7.1經過驗證,大腸埃希菌、枯草芽孢桿菌、白色念珠菌、黑曲霉的回收率分別為 %、 %、 %、 %、 %。
7.2稀釋劑回收率為 %、 %、 %、 %、 %。
以上驗證結果證明,本品 采用上述方法進行微生物限度檢查。
檢驗人: 復核人:
8.驗證結果評價分析
質控部負責各項驗證、試驗結果記錄,驗證小組根據驗證、試驗結果進行評價,起草驗證報告,報驗證委員會。
驗證委員會負責對驗證結果進行綜合評審,做出驗證結論,發放驗證證書。對驗證結果的評審應包括:
(1) 驗證試驗是否有遺漏;
(2) 驗證實施過程中對驗證方案有修改原因、依據以及是否經過批準;
(3) 驗證記錄是否完整;
(4) 驗證試驗結果是否符合標準要求,偏差及對偏差的說明是否合理,是否需進一步補充試驗。
9.*終審批
驗證報告由驗證組長審核后,報驗證總負責人批準,并簽發驗證證書。
驗證報告
年 月 日至 年 月 日,驗證小組根據批準的微生物限度檢查方法(薄膜過濾法)驗證文件對微生物限度檢查法進行了相關的一系列驗證工作,達到了預期效果,滋將有關事項說明如下:
1、 驗證方案在實施過程中未做修改。
2、 驗證方案各項性能指標在驗證中未作變動,誤差在允許范圍內。
3、 驗證過程中結果符合規定要求,記錄完整屬實。
4、 驗證結果符合設計要求和GMP原則要求,可以投入使用。
5、 組分或檢驗條件改變時須重新驗證。
以上情況,請驗證委員會審批!
驗證小組:
年 月 日









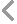







 采購中心
采購中心
 化工儀器網
化工儀器網