| 產地類別 | 國產 | 價格區間 | 5萬-10萬 |
|---|---|---|---|
| 應用領域 | 化工,生物產業,農業,石油,建材 |
河北中宇催化劑評價設備,固定床反應裝置
催化反應特點
一種催化劑只能選擇性地加速特定的反應,從而可能使化學反應朝著幾個熱力學可能的方向之一進行。催化劑與反應物處于同一相的稱均相催化反應(Homogeneous Catalytic Reaction),處于不同相者稱異相催化反應(或多相催化反應)(Heterogeneous Catalytic Reaction)。由生物催化劑-酶參加的反應稱酶催化反應(Enzymic Catalytic Reaction)。大部分工業反應是催化反應。生物體內的新陳代謝、營養和能量轉換是酶催化反應過程。
相較于未催化的反應,同溫度的催化反應擁有較低的活化能。催化劑可以借由結合反應物達到極化的效果,如酸催化劑之于羰基化合物的合成;催化劑也可產生非自然的反應中間物,如以催化烯烴的雙羥基化中產生的鋨酸鹽酯;催化劑亦可造成反應物的裂解,如制氫時產生的單原子氫。 [1]
催化劑簡介
在化學反應中能改變反應速度而本身的組成和質量在反應前后保持不變的物質,叫做催化劑。能加快反應速度的叫做正催化劑;能減慢反應速度的稱為負催化劑或緩化劑。通常所說的催化劑是指正催化劑。常用的催化劑主要有金屬、金屬氧化物和無機酸等。催化劑一般具有選擇性,能改變某一個或某一類型反應的速度。另外有些化學反應因反應條件不同(包括不同的催化劑)會生成不同的產物。催化反應是在催化劑的作用下進行的化學反應。例如二氧化硫和氧在催化劑作用下合成三氧化硫,氮和氫在催化劑作用下合成氨等都屬于催化反應。 [1]
河北中宇催化劑評價設備,固定床反應裝置
催化劑作用
催化劑是一種能夠改變一個化學反應的反應速度,卻不改變化學反應熱力學平衡位置,本身在化學反應中不被明顯地消耗的化學物質。
①加快化學反應速率,提高生產能力;
②對于復雜反應,可有選擇地加快主反應的速率,抑制副反應,提高目的產物的收率;
③改善操作條件,降低對設備的要求,改進生產條件;
④開發新的反應過程,擴大原料的利用途徑,簡化生產工藝路線;
催化反應分類
按反應機理進行分類,可將催化反應分為酸堿型催化反應、氧化還原型催化反應;按反應類型分類,可分為加氫、脫氫、氧化、羰基化、聚合、鹵化、裂解、水合、烷基化、異構化等。 [2]
危險性及安全
催化反應分為單相反應和多相反應兩種。單相反應是在氣態下或液態下進行的,反應過程中的溫度、壓力及其他條件較易調節,危險性較小。在多相反應中,催化作用發生于相界面及催化劑的表面上,這時溫度、壓力較難控制.危險性較大。催化反應應正確選擇催化劑,催化劑加量適當,保證散熱良好,防止局部反應激烈,并注意嚴格控制溫度。如果催化反應過程能夠連續進行,采用溫度自動調節系統,就可以減少其危險性。
在催化反應中,當原料氣中雜質和催化劑發生反應,可能會生成爆炸性危險物,這是非常危險的。例如,在乙烯催化氧化合成乙醛的反應中,由于在催化劑體系中含有大量的亞銅鹽,若原料氣中含有乙炔過高,則乙炔與亞銅反應生成乙炔銅,其為紅色沉淀,自燃點在260~270℃,在干燥狀態下極易爆炸,在空氣作用下易氧化并燃燒。烴與催化荊中的金屬鹽作用生成難溶性的把塊,不僅使催化劑組成發生變化。而且把塊也極易引起爆炸。
在催化反應過程中有的產生氯化氫,有腐蝕和中毒危險;有的產生硫化氫,則中毒危險性更大。另外,硫化氫在空氣中的爆炸極限較寬,生產過程還有爆炸危險性。在產生氫氣的催化反應中,有更大的爆炸危險性,尤其高壓下,氫的腐蝕作用使金屬高壓容器脆化,從而造成破壞性事故。









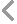







 采購中心
采購中心
 化工儀器網
化工儀器網