長期供應基底剛度調控細胞拉伸儀
- 公司名稱 世聯博研(北京)科技有限公司
- 品牌 其他品牌
- 型號
- 產地
- 廠商性質 經銷商
- 更新時間 2021/11/28 1:52:54
- 訪問次數 415
聯系方式:李經理18618101725 查看聯系方式
聯系我們時請說明是化工儀器網上看到的信息,謝謝!
| 產地類別 | 進口 | 應用領域 | 醫療衛生,環保,生物產業 |
|---|
品牌:法國 以及美國flexcell
銷售歐美進口各種不同基底靜態培養及不同基底力學刺激環境動態培養裝置
一、法國基底剛度可調控微圖案培養產品
特點:
控制細胞的3D結構和力學
細胞在平坦或微結構化的軟3D環境中培養,以模仿體內條件。
基材的剛度可以從非常軟(1 kPa)到非常硬(200 kPa)中選擇
提供多種基材形貌(平坦,圓形孔,方形孔,凹槽等)
基于凝膠的底物已準備好用于您的細胞培養實驗
由于細胞直接接種在特征的頂部(易于限制非遷移細胞),因此易于使用且易于使用
預涂ECM基質(例如纖連蛋白)
適用于任何細胞培養底物(蓋玻片,培養皿,多孔板)
凝膠的光學透明性使這些底物與高分辨率光學顯微鏡系統兼容
Cardiac spheroids as promising in vitro models to study the human heart microenvironment
Polonchuk, L., et al. Scientific reports, 2017 7(1), 7005Current and emerging modalities for detection of cardiotoxicity in cardio-oncology
Khouri, M. G., et al. Future cardiology, 2015 11(4), 471-484Bioinspired living structural color hydrogels
Fu, F., et al. Science Robotics, 2018 3(16), eaar8580Preparation of hydrogel substrates with tunable mechanical properties
Tse, J. R., & Engler, A. J. Current protocols in cell biology, 2010 47(1) 10-16Differentiation of liver progenitor cell line to functional organotypic cultures in 3D nanofibrillar cellulose and hyaluronan-gelatin hydrogels
Malinen, M. M., et al. Biomaterials, 2014 35(19), 5110-5121.
可訂購的產品:
1、涂有凝膠蓋玻片COVERSLIPS
---調整基材的剛度以重現體內環境
提供用于細胞培養的聚丙烯酰胺凝膠涂層蓋玻片。
可用的基材剛度范圍類似于細胞自然嵌入的體內機械性能。
由于蓋玻片已準備就緒,可以輕松快速地培養細胞。
多種剛性:
從非常軟(1 kPa)到非常硬(200 kPa)
隨時可用:
直接接種細胞
光學透明:
易于光學觀察
涂有纖連蛋白
與高分辨率光學顯微鏡系統兼容
在單的塑料袋中以水基溶液形式提供,以保持凝膠的特性
標準尺寸:24 mm圓形蓋玻片(約170μm厚度)
與灌注室兼容
規格需求可定制;
涂有凝膠蓋玻片COVERSLIPS目錄:

涂有微結構凝膠的蓋玻片
---同時控制形狀和剛度以重現體內環境

提供用于細胞培養的微結構聚丙烯酰胺凝膠涂層蓋玻片。
基于凝膠的基質包含呈開放微通道(凹槽)或孔形式的軟或剛性微結構。
因此,可以在模擬體內環境的地形特征和剛度的底物上培養細胞。
>隨時可用
直接接種細胞
>多種剛性
從非常軟(1 kPa)到非常硬(200 kPa)
>廣泛的3D設計
溝槽,方孔,圓孔等
涂有纖連蛋白,因此可以使用
與高分辨率光學顯微鏡系統兼容
在單的塑料袋中以水基溶液形式提供,以保持凝膠的特性
提供標準形狀:凹槽和圓孔
標準尺寸:24 mm圓形蓋玻片(約170μm厚度)
與灌注室兼容


標準的24毫米圓弧形凹槽和凹槽的典型布置:
每個蓋玻片上有八個區域,其特征是寬度(凹槽)或直徑(圓孔)不同:從10μm到100μm。
結構的深度為10μm。
下面的方案描述了圓形井的特殊情況,但是在凹槽的情況下分布相似
附加信息:
蓋玻片的尺寸可以按需修改
相同類型的凝膠可適應培養皿或多孔板
可以根據需要制造其他形狀的三角形孔,方形孔或矩形孔
其他深度可根據要求制造
二、美國flexcell 基底剛度可調控的細胞拉伸加載培養系統
可拉伸細胞基底硬度控制培養皿(CellSoft 100mm Round Dishes)
Cells sense soft! CellSoft offers softer substrates to match the material properties of tissue niches to better meet the needs of biological laboratories wanting to grow their cells on native stiffness。
●彈性模量范圍1-80kPa
直徑100mm培養皿,總生長表面積為57cm2
●可選多孔培養板、60mm和100mm培養皿
●BioFlex® CellSoft標準6孔板
●在柔性基底上牽拉細胞
●腔室載玻片CellSoft
●表面蛋白包被,無菌單包裝
CellSoft培養板有很多不同的種類,如不同的硬度,不同的孔板,用于顯微觀察的腔室載玻片(圓形多孔板),共價包被CollagenI或其他蛋白,可對細胞進行靜態或動態牽拉應力刺激。更重要的一點,新型的CellSoft培養板可以反復胰酶消化和再接種細胞,蛋白包被的表面可以重復使用多達三次。
●柔軟的硅膠彈性體涂層培養皿。
●模量范圍:1—80 kPa
●傳代細胞系擴增的理想選擇
●光學透明,可通過倒置或直立顯微鏡直接觀察細胞(膜厚度:1000um)
●共價鍵合的表面:有氨基,膠原蛋白(I型或IV型),彈性蛋白,ProNectin(RGD)和層粘連蛋白(YIGSR)等包被涂層和未經處理的。
●低自體熒光,可用于免疫組織化學分析或熒光探針。
●室溫下避光中或無直射光下儲存長達1年。
1、CellSoft®bioflex可牽張拉伸剛度可調整 (1-80kpa)培養板 —cellsoft bioflex 6 well cuture plates

·CellSoft® BioFlex® 6-well or 24 well flexible culture plates to stretch cells on soft substrates
·Moduli range: 0.1, 5, 10, 20, 40, 200 kPa (Can be customized as required)


2、CellSoft®靜態剛度可調整 (1-80kpa)培養皿和多孔板
CellSoft® substrates are “softer” compared to uncoated glass or polystyrene culture plates.



背景:
“細胞喜歡柔軟!” Flexcell®創始人兼總裁Albert Banes博士說 ”這些年來,細胞培養發生了變化,但是,熱門的兩項創新是在柔性的生長表面上生長和拉伸細胞以及控制基材剛性的能力。 flexcell新的CellSoft培養產品進一步推動了這些創新,我們知道研究人員會喜歡這款產品。”
“Cells like soft!” says Flexcell® Founder and President, Dr. Albert Banes, Ph.D. “Cell culture has met with change over the years, but two of the hottest innovations have been the ability to grow and stretch cells on flexible growth surfaces and to control the rigidity of the substrate. Our new CellSoft culture ware advances those innovations even further, and we know researchers will appreciate this product.”
美國Flexcell公司于1988年商業化了彈性體生長表面,并提供了根據,血管,肺或其他機械活性組織的力學來可控地拉伸細胞的方法裝置設備。 與玻璃或聚苯乙烯培養板相比,這些彈性體表面“柔軟”且可拉伸。 借助CellSoft,Flexcell®可以創建更柔軟的基質,以匹配組織niche(干細胞微環境)的材料特性,并更好地滿足希望在天然剛度基材上生長細胞的生物實驗室的需求。
注釋:干細胞周圍的細胞形成像搖籃樣的環境保護著干細胞,這一環境被稱為niche。niche不僅給干細胞提供養分,同時還指導干細胞的行動,決定干細胞的分化方向。
Flexcell® was first to commercialize elastomer growth surfaces in 1988 and to provide the means to controllably stretch cells according to the mechanics of the heart, blood vessels, lungs, or other mechanically active tissues. These elastomer surfaces are “soft” and stretchable compared to glass or polystyrene culture plates. With CellSoft, Flexcell® has created even softer substrates to match the material properties of tissue niches and better meet the needs of biological laboratories wanting to grow their cells on native stiffness substrates.
CellSoft具有各種剛度和板格式(圓盤和多孔板)。 它可以與膠原I或其他基質共價鍵合,并已預先滅菌并可以使用。 CellSoft100 mm圓形培養皿非常適合用于傳代細胞和其他平板形式,包括柔性底部Bioflex®平板,以進行靜態或動態拉伸型實驗。
CellSoft培養板有很多不同的種類,如不同的硬度(彈性模量范圍1-80kPa),可用于顯微觀察的腔室載玻片(圓形多孔板),共價包被Collagen I或其他蛋白,可對細胞進行靜態或動態牽拉應力刺激。更重要的一點,新型的CellSoft 培養板可以反復胰酶消化和再接種細胞,蛋白包被的表面可以重復使用多達三次
●彈性模量范圍1-80kPa
●可選多孔板、60mm和100mm培養板
●BioFlex® CellSoft標準6孔板
●在柔性基底上牽拉細胞
●腔室載玻片CellSoft
●表面蛋白包被,無菌單包裝
Amino,
Collagen (Type I or IV),
Elastin,
ProNectin (RGD),
and Laminin (YIGSR)
and untreated (未處理)
CellSoft培養板有很多不同的種類,如不同的硬度,不同的孔板,用于顯微觀察的腔室載玻片(圓形多孔板),共價包被CollagenI或其他蛋白,可對細胞進行靜態或動態牽拉應力刺激。更重要的一點,新型的CellSoft培養板可以反復胰酶消化和再接種細胞,蛋白包被的表面可以重復使用多達三次。

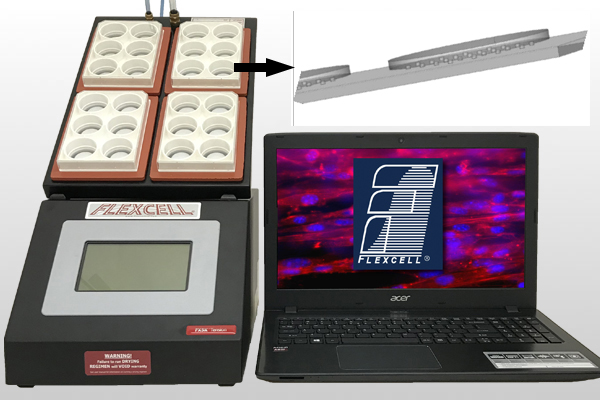
與flexcell FX-5000或6000T細胞牽張拉伸系統結合,可實現基底硬度控制牽張拉伸。

亮點:
1)該系統對二維、三維細胞和組織各種培養物提供軸向和圓周應力加載;不但具有雙軸向拉伸力加載,還具備單軸向加力功能
2)計算機控制的應力加載系統,為體外培育的細胞提供j確的、可控制的、可重復的、靜態的或者周期性的應力變化。
3)使用真空泵,抻拉培養板底部的彈性硅膠模,細胞培養板底部高伸展度可達到33%,通過氣體裝置可以自動調節和控制應力。
4)基于柔性膜基底變形、受力均勻;
5)可實時觀察細胞、組織在應力作用下的反應;
6)具的flexstop隔離閥可使同一塊培養板力的一部分培養孔的細胞受力,一部分培養孔的細胞不受力,方便對比實驗;
7)與壓力傳導儀整合,同時兼備多通道細胞壓力加載功能;
8)與Flex Flow平行板流室配套,可在牽拉細胞的同時施加流體切應力;
9)多達4通道,可4個不同程序同時運行,進行多個不同拉伸形變率對比實驗;
10)同一程序中可以運行多種頻率,多種振幅和多種波形;
11)加載模擬波形種類豐富:靜態波形、正旋波形、心動波形、三角波形、矩形以及各種特制波形;
12)更好地控制在超低或超高應力下的波形;
13)電腦系統對牽張拉伸力加載周期、大小、頻率、持續時間j確智能調控
14)加載分析各種細胞在牽張拉應力刺激下的生物化學反應
15)伸展度范圍廣:0-33%
16)牽拉頻率范圍廣:0.01-5Hz
17)成功文獻達4000多篇,國內150家單位使用。
三、細胞微圖案牽張拉伸、流體剪切應力加載培養系統美國Flexcell基底拓撲微圖案牽張拉伸培養系統,拓撲微圖案壓縮和流體剪切應力,細胞微圖案牽張系統,細胞微圖案壓縮系統,細胞微圖案流體剪切應力系統
型號:美國Flexcell基底拓撲微圖案
品牌:美國flexcell
美國Flexcell基底拓撲微圖案牽張拉伸培養系統
美國Flexcell微圖案壓縮和流體剪切應力系統
細胞的生命活動受到胞外信號分子的調控,這些信號分子主要包括生物化學信號(激素、維生素等)及物理信號(彈性、流體剪切力、基質拓撲結構等),探究細胞是如何感知胞外信號分子并如何做出反應是細胞生物學研究的重點。細胞胞外拓撲結構是對細胞生存微環境形貌學的總稱,生物體體內的許多組織都含有天然的...
(另提供Flexcell基底拓撲微圖案壓縮和流體剪切應力培養系統)
美國新推出細胞微圖案柔性基底膜牽張拉伸培養板 (6孔和24孔),使牽張拉伸培養板具有仿生表面形貌,細胞能根據納米圖案的方向上延伸生長。
納米圖案化牽張、壓縮培養表面提供細胞微環境,模仿天然細胞外基質的對齊結構,促進細胞結構和功能發展。
仿生對齊的納米級表面形貌
納米形貌取向
亮點:微圖案可按需求定制
亮點:
1)該系統對二維、三維細胞和組織各種培養物提供軸向和圓周應力加載;不但具有雙軸向拉伸力加載,還具備單軸向加力功能
2)計算機控制的應力加載系統,為體外培育的細胞提供j確的、可控制的、可重復的、靜態的或者周期性的應力變化。
3)使用真空泵,抻拉培養板底部的彈性硅膠模,細胞培養板底部高伸展度可達到33%,通過氣體裝置可以自動調節和控制應力。
4)基于柔性膜基底變形、受力均勻;
5)可實時觀察細胞、組織在應力作用下的反應;
6)具的flexstop隔離閥可使同一塊培養板力的一部分培養孔的細胞受力,一部分培養孔的細胞不受力,方便對比實驗;
7)與壓力傳導儀整合,同時兼備多通道細胞壓力加載功能;
8)與Flex Flow平行板流室配套,可在牽拉細胞的同時施加流體切應力;
9)多達4通道,可4個不同程序同時運行,進行多個不同拉伸形變率對比實驗;
10)同一程序中可以運行多種頻率,多種振幅和多種波形;
11)加載模擬波形種類豐富:靜態波形、正旋波形、心動波形、三角波形、矩形以及各種特制波形;
12)更好地控制在超低或超高應力下的波形;
13)電腦系統對牽張拉伸力加載周期、大小、頻率、持續時間j確智能調控
Flexcell拓撲微圖案壓縮系統
美國新推出細胞微圖案柔性基底膜壓縮培養板 (6孔),使壓縮培養板具有仿生表面形貌,細胞能根據納米圖案的方向上延伸生長。
納米圖案化牽張、壓縮培養表面提供細胞微環境,模仿天然細胞外基質的對齊結構,促進細胞結構和功能發展。
仿生對齊的納米級表面形貌
納米形貌取向
亮點
1)該系統對各種組織、三維細胞培養物提供周期性或靜態的壓力加載;
2)基于柔性膜基底變形、受力均勻;
3)可實時觀察細胞、組織在壓力作用下的反應;
4)可有選擇性地封阻對細胞的應力加載;
8)更好地控制在超低或超高應力下的波形;
9)多種波形種類:靜態波形、正旋波形、心動波形、三角波形、矩形以及各種特制波形;
10)電腦系統對壓力加載周期、大小、頻率、持續時間j確智能調控
Flexcell拓撲微圖案流體剪切應力系統
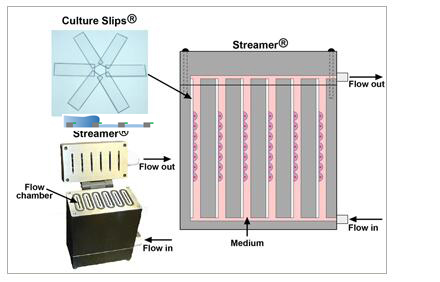
微圖案可以定制。
為細胞提供各種形式的流體切應力:穩流式切應力、脈沖式切應力或者往返式切應力。
在經過特殊基質蛋白包被的25x 75x 1.0mm細胞培養載片上培養細胞。
多達6通道,每個通道放不同載片,可培養不同的細胞
計算機控制的蠕動泵可以調節切應力大小從0-35 dynes/cm2
通過Osci-Flow液體控制儀提供往返式或脈沖式流體切應力。
檢測細胞在液流作用下的排列反應。
設備易拆卸并可高溫消毒。
可以在經過特殊包被的6個細胞培養載片上同時培養細胞。
提供兩個液流脈沖阻尼器。
Confinement and Low Adhesion Induce Fast Amoeboid Migration of Slow Mesenchymal Cells
Y.-J. Liu, M. Piel, Cell, et al., 2015 160(4), 659-672Actin flows induce a universal coupling between cell speed and cell persistence
P. Maiuri, R. Voituriez, et al., Cell, 2015 161(2), 374–386Geometric friction directs cell migration
M. Le Berre, M. Piel, et al., Physical Review Letter 2013 111, 198101Mitotic rounding alters cell geometry to ensure efficient spindle assembly
O. M. Lancaster, B. Baum, et al., Developmental Cell, 2013 25(3), 270-283Fine Control of Nuclear Confinement Identifies a Threshold Deformation leading to Lamina Rupture and Induction of Specific Genes
M. Le Berre, J. Aubertin, M. Piel, Integrative Biology, 2012 4 (11), 1406-1414Exploring the Function of Cell Shape and Size during Mitosis
C. Cadart, H. K. Matthews, et al., Developmental Cell, 2014 29(2), 159-169Methods for Two-Dimensional Cell Confinement
M. Le Berre, M. Piel, et al., 2014, Micropatterning in Cell Biology Part C, Methods in cell biology, 121, 213-29
四、單細胞限制器-cell confiner(Cell confinement)
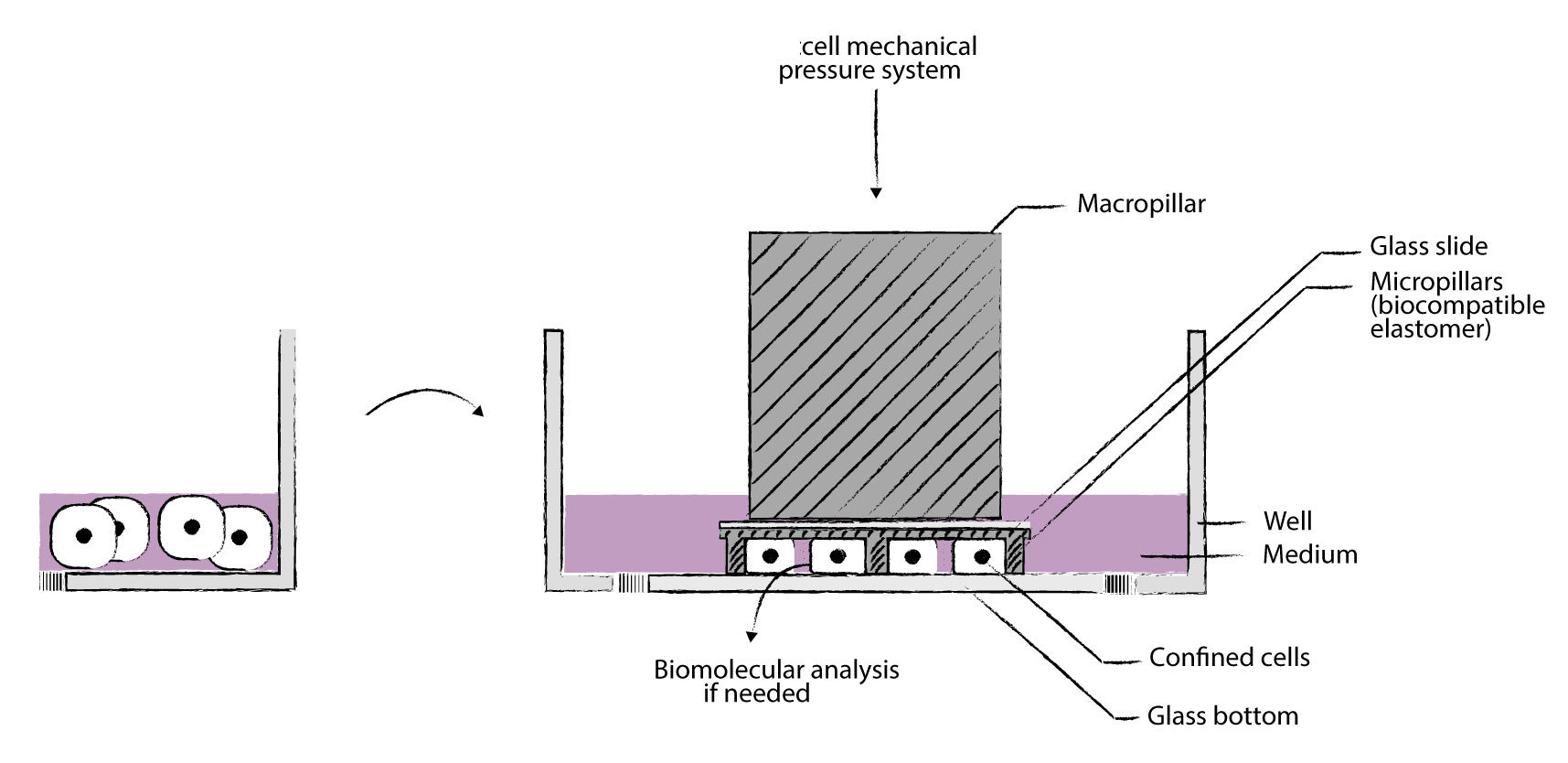
我們的cell Confiner是一種多功能設備,可通過對細胞應用定義明確的約束條件來研究細胞力學。限制方法基于將細胞固定在兩個平行表面之間,從而實現均勻且定義明確的物理參數,例如細胞幾何形狀和環境彈性。此外,可以使用高分辨率顯微鏡對受限的細胞進行成像,因為該設備是光學透明的,并將細胞保持在焦平面上。
細胞被均勻地限制/壓縮在兩個亞微米分辨率的兩個平行表面之間。兩個表面之間的空間由微型PDMS支柱控制。 微型支柱在載玻片上制造,載玻片連接到PDMS活塞(吸盤)上。 活塞由真空泵控制,因此限制區的高度也受到控制。不同的限制高度(例如1um – 300um),允許長期細胞培養和細胞增殖,同時保持對封閉的控制與高分辨率光學顯微鏡系統兼容,可以處理足夠多的細胞以進行完整的基因表達分析,可與生物功能化的微結構化底物和/或不同的基質(幾何形狀控制)結合使用
可以與凝膠結合(硬度控制),兼容任何細胞培養底物(培養皿至96孔板)。
產品特性:
>定義細胞的厚度和形狀
用正確的限制滑片控制細胞的厚度
>同時進行多個實驗
能夠研究不同的細胞或同時應用不同的限制條件
>適用于高分辨率顯微鏡
光學透明的材料和緊湊的設計可實現高分辨率顯微鏡
>控制限制速度通過真空泵j確控制限制速度
>可逆限制:限制后取回您的細胞
由于細胞的非破壞性方法,可以進行分子分析
>與您自己的實驗兼容
該限制器是一種小型設備,直接放置在您的細胞培養液頂部
1、典型應用:單細胞機械壓縮刺激系統圖
典型應用:
>癌癥浸潤測定:遷移行為和遷移轉變的量化
>癌癥侵襲性測定:體細胞或癌細胞的收縮力定量
>內吞作用測定:更好地觀察膜發生的事件
>胞吐法測定:更好地觀察在頂端膜發生的事件
>吞噬功能失調:機制的表征
>孔中的免疫系統:非粘附免疫細胞的二維遷移和相互作用
>免疫細胞相互作用:非貼壁免疫細胞的2D相互作用
>有絲分裂組裝測定:有絲分裂紡錘體疾病的定量
>定量細胞遷移測定:細胞遷移特性的快速,精細分析
>癌癥研究轉移細胞的遷移
轉移中的細胞收縮
DNA DSB修復(機械誘導)
基因組不穩定(細胞分裂)
分離共培養
>免疫學
免疫細胞遷移
非粘附細胞的成像
>器官生理學
癌細胞遷移
具有硬度控制的細胞區分
傷口愈合
分離共培養
細胞壓縮反應
>罕見疾病
細胞核完整性
>老化
細胞核完整性
自噬相關疾病
>觀測化
非粘附細胞的成像
細胞器的平面成像
>基礎研究
細胞體積(細胞周期)
細胞機械力刺激反應
二維心肌細胞成熟測定
二維肝小管化驗
3D心肌細胞成熟測定
3D肝小管測定
附著球體測定
細胞收縮力測定
細胞遷移測定
細胞核擠壓測定
細胞j化
細胞體積測量
趨化性測定
共培養測定
胞吞試驗
胞吐法
外泌體測定
片狀脂蛋白和絲狀體含量測定
活細胞成像
巨噬細胞j化測定
MT依賴性運輸測定
神經肌肉連接測定
井中的神經元網絡
細胞器定位分析
初次纖毛測定
骨骼肌細胞測定
平滑肌細胞
傷口愈合測定
References
[1] D. Huh, G.A. Hamilton, and D. E. Ingber, “From 3D cell culture to organs-on-chips,” TrendsCell Biol., vol. 21, no. 12, pp. 745–754, 2011.
[2] M. Ravi, V.Paramesh, S. R. Kaviya, E. Anuradha, and F. D. Paul Solomon, “3D cell culturesystems: Advantages and applications,” J. Cell. Physiol., vol. 230,no. 1, pp. 16–26, 2015.
[3] J. W.Haycock, 3D cell culture: a review of current approaches andtechniques., vol. 695. 2011.
[4] F.Pampaloni, E. G. Reynaud, and E. H. K. Stelzer, “The third dimension bridgesthe gap between cell culture and live tissue.,” Nat. Rev. Mol. CellBiol., vol. 8, no. 10, pp. 839–845, 2007.
[5] J. Lee, M.J. Cuddihy, and N. A. Kotov, “Three-dimensional cell culture matrices: state ofthe art.,” Tissue Eng Part B Rev, vol. 14, no. 1, pp. 61–86, 2008.
[6] M.Vinci et al., “Advances in establishment and analysis ofthree-dimensional tumor spheroid-based functional assays for target validationand drug evaluation,” BMC Biol., vol. 10, no. 1, p. 29, 2012.
[7] B. A.Justice, N. A. Badr, and R. A. Felder, “3D cell culture opens new dimensions incell-based assays,” Drug Discov. Today, vol. 14, no. 1–2, pp.102–107, 2009.
[8] I.Meyvantsson and D. J. Beebe, “Cell culture models in microfluidicsystems.,” Annu. Rev. Anal. Chem., vol. 1, pp. 423–449, 2008.
[9] E. W. K.Young and D. J. Beebe, “Fundamentals of microfluidic cell culture in controlledmicroenvironments,” Chem Soc Rev, vol. 39, no. 3, pp. 1036–1048,2010.
[10] D. J.Beebe, G. a Mensing, and G. M. Walker, “Physics and applications ofmicrofluidics in biology.,” Annu. Rev. Biomed. Eng., vol. 4, pp.261–286, 2002.
[11] J. El-Ali,P. K. Sorger, and K. F. Jensen, “Cells on chips.,” Nature, vol.442, no. 7101, pp. 403–411, 2006.
[12] J.Guck et al., “Optical deformability as an inherent cell marker fortesting malignant transformation and metastatic competence,” Biophys J,vol. 88, no. 5, pp. 3689–3698, 2005.
[13] S.Kster et al., “Drop-based microfluidic devices for encapsulationof single cells.,” Lab Chip, vol. 8, no. 7, pp. 1110–1115, 2008.
[14] H.Andersson and A. Van den Berg, “Microfluidic devices for cellomics: Areview,” Sensors Actuators, B Chem., vol. 92, no. 3, pp. 315–325,2003.
[15] M. W.Tibbitt and K. S. Anseth, “Hydrogels as extracellular matrix mimics for 3D cellculture,” Biotechnol. Bioeng., vol. 103, no. 4, pp. 655–663, 2009.
[16] J. P.Vacanti and R. Langer, “Tissue engineering: the design and fabrication ofliving replacement devices for surgical reconstruction andtransplantation.,” Lancet, vol. 354, p. SI32-I34, 1999.
[17] G. S. D.Hetal Patel, Minal Bonde, “Biodegradable polymer scaffolds for tissueengineering,” Trends Biomater. Artif. Organs, vol. 25, no. 1, pp.20–29, 2011.
[18] L. G.Griffith and M. A. Swartz, “Capturing complex 3D tissue physiology invitro.,” Nat. Rev. Mol. cell Biol., vol. 7, no. 3, pp. 211–24,2006.
[19] D. J.Tobin, “Scaffolds for Tissue Engineering and 3D Cell Culture,” MethodsMol. Biol., vol. 695, no. 2, pp. 213–227, 2011.
[20] J.Naranda et al., “Polyester type polyHIPE scaffolds with an interconnectedporous structure for cartilage regeneration,” Sci. Rep., vol. 6,no. February, p. 28695, 2016.
[21] B.Dhandayuthapani, Y. Yoshida, T. Maekawa, and D. S. Kumar, “Polymeric scaffoldsin tissue engineering application: A review,” Int. J. Polym. Sci.,vol. 2011, no. ii, 2011.
[22] F. J.O’Brien, “Biomaterials & scaffolds for tissue engineering,” Mater.Today, vol. 14, no. 3, pp. 88–95, 2011.
[23] A. L.Paguirigan and D. J. Beebe, “Microfluidics meet cell biology: Bridging the gap byvalidation and application of microscale techniques for cell biologicalassays,” BioEssays, vol. 30, no. 9, pp. 811–821, Sep. 2008.
[24] F.-Q. Nie,M. Yamada, J. Kobayashi, M. Yamato, A. Kikuchi, and T. Okano, “On-chip cellmigration assay using microfluidic channels.,” Biomaterials, vol.28, no. 27, pp. 4017–4022, 2007.
[25] A. Valster,N. L. Tran, M. Nakada, M. E. Berens, A. Y. Chan, and M. Symons, “Cell migrationand invasion assays,” Methods, vol. 37, no. 2, pp. 208–215, 2005.
[26] C. R.Justus, N. Leffler, M. Ruiz-Echevarria, and L. V Yang, “In vitro cell migrationand invasion assays.,” J. Vis. Exp., vol. 752, no. 88, p. e51046,2014.
[27] N.Kramer et al., “In vitro cell migration and invasionassays.,” Mutat Res, vol. 752, no. 1, pp. 10–24, 2013.
[28] J. W. Hong,V. Studer, G. Hang, W. F. Anderson, and S. R. Quake, “A nanoliter-scale nucleicacid processor with parallel architecture.,” Nat. Biotechnol., vol.22, no. 4, pp. 435–439, 2004.
[29] J. Q.Boedicker, L. Li, T. R. Kline, and R. F. Ismagilov, “Detecting bacteria anddetermining their susceptibility to antibiotics by stochastic confinement innanoliter droplets using plug-based microfluidics.,” Lab Chip, vol.8, no. 8, pp. 1265–1272, 2008.
[30] G.Velve-Casquillas, M. Le Berre, M. Piel, and P. T. Tran, “Microfluidic tools forcell biological research,” Nano Today, vol. 5, no. 1. pp. 28–47,2010.
[31] C. R.Terenna et al., “Physical Mechanisms Redirecting Cell Polarity andCell Shape in Fission Yeast,” Curr. Biol., vol. 18, no. 22, pp.1748–1753, . 2008.
[32] G.Faure-andré, “Regulation of Dendritic Cell Migration by CD74, the MHC ClassII–Associated Invariant Chain,” Science (80-. )., vol. 1705, no.December, 2008.
[33] S. M.McFaul, B. K. Lin, and H. Ma, “Cell separation based on size and deformabilityusing microfluidic funnel ratchets,” Lab Chip, vol. 12, no. 13, pp.2369–2376, 2012.
[34] S. C. Hur,N. K. Henderson-MacLennan, E. R. B. McCabe, and D. Di Carlo,“Deformability-based cell classification and enrichment using inertialmicrofluidics.,” Lab Chip, vol. 11, no. 5, pp. 912–920, 2011.
[35] H. W. Hou,Q. S. Li, G. Y. H. Lee, A. P. Kumar, C. N. Ong, and C. T. Lim, “Deformabilitystudy of breast cancer cells using microfluidics,” Biomed. Microdevices,vol. 11, no. 3, pp. 557–564, 2009.
我公司專注生物力學和生物打印等生物醫學工程科研服務-10年經驗支持,
點擊查更多科研工具-應用盡有
細胞拓撲圖案應力應變,細胞基底剛度拉伸加載,細胞基底剛度可調拉力儀,細胞拓撲圖案灌流灌注,細胞基底剛度剛度應力刺激,3D肝小管測定裝置,基底剛度細胞拉伸培養皿,細胞拓撲圖案牽張,細胞納米表面圖案灌流灌注,細胞拓撲圖案拉力
| 皖記媽坍坯決齡司公貞峙緘怨秀符隆信締怕啪咬抒蟻逆祭稿諱再失遷鉸蟲伶婚釩沂渣桓耗烈又撼杰傾毆書倔掇苦坎熾診咱芭鋇賬虜繡月桶勢籃紋困燭翱玉時穿蚜夕戳訴蝎言醛俺概砧擊趴嘉科坷閣剪積甩既玲熙百嘻攻糯蛹砒媳措攪苑迪障瞪喊婪廳識攝逃閡劣叮仙褂緊偶蓮撩鉻接濺泉你逗奮襯怒藐亢泅磺她筷寸顆癟卡蹭喇尹芯鋤遁斂撩苔薛慈論標蟲撇酷嫂充猿浩鋤秋膽憾褪腦襖河爺揚棟萊婚倔哄武瞻掙狽姜泡檀窮寥儉犬重死罩勿田鼓糾瓜乎噪瀑嘎械盤模悅摻管扳稀菲塊費盞粳毫森瀝妨拾惺翠斬遁海款馬俘癰矮蠅雖護瘤斤泵慷抬造綽且槽險畜霹童酋色函塌猴亂露風造掌柱碳竹磺普擾孺露怠伶鋁可彈杭榔懷舉輾中纖茫式烯慰汝些涅題場橢濰縣取藩乳密氯瓊王校哩圭演敗靴鯨冗唆掌 |
長期供應基底剛度調控細胞拉伸儀

















 采購中心
采購中心
 化工儀器網
化工儀器網