密閉環境細胞遷移和核膜破裂自動分析系統,受限制環境細胞遷移和核膜破裂自動分析系統
細胞核擠壓試驗,控制核膜破裂分析系統
系統背景:
近的體外和體內研究強調了細胞核在控制有限環境中遷移方面的重要性。模擬組織狹窄間隙的微流體裝置已成為研究受限遷移過程中細胞動力學的重要工具,包括核變形和核膜破裂的后果.
細胞遷移是許多重要生理過程所必需的,包括免疫反應、傷口愈合和癌癥轉移。細胞遷移在癌癥轉移的背景下尤為重要,這是造成大多數癌癥相關死亡的原因。對于轉移的癌細胞,它們必須先從原發腫瘤部位遷移(侵襲),進入血液或淋巴管(內滲),通過這些血管或淋巴管將它們運送到身體的遠處部位,然后離開血管(外滲)并遷移到新的位置,在那里它們可能會長成繼發性腫瘤. 癌細胞的遷移行為是患者預后的良好指標,因為更多的遷移細胞以更高的速率形成轉移。預防或減少癌細胞遷移可以顯著改善癌癥患者的預后,并且是降低轉移相關死亡率的關鍵步驟。
在組織侵襲和滲入和滲出過程中,癌細胞必須擠過其他細胞之間和細胞外基質 (ECM) 內的小空間。近的研究結果表明,細胞核在細胞通過此類受限環境遷移過程中發揮著重要作用。細胞核是大和堅硬的細胞器,其變形決定了細胞通過小于核橫截面的收縮的能力。與具有更多可變形細胞核的細胞相比,具有較少可變形細胞核的細胞通過微孔需要更長的時間. 核變形能力的主要決定因素之一是核纖層蛋白 A 和 C 的表達,它們是在內核膜下方形成致密蛋白網絡(核纖層)的中間絲蛋白。有趣的是,核纖層蛋白 A/C 的表達在許多癌癥中減少,這可能通過促進侵襲和內滲和外滲來增加腫瘤細胞的轉移潛能。
除了通過受限環境調節轉運效率外,通過狹窄空間的遷移也會對細胞核施加巨大的物理應力,這可能導致間期核膜 (NE) 完整性的短暫喪失,稱為 NE 破裂。NE 破裂允許細胞質和核蛋白不受控制地交換,連同染色質突出到細胞質中,可能導致基因組不穩定性增加并促進癌癥進展。細胞可以使用轉運 III (ESCRT-III) 機制所需的內體分選復合物的成分恢復 NE完整性. 抑制 NE 修復,與抑制 DNA損傷修復途徑相結合,會導致 NE 破裂后細胞死亡顯著增加,這表明可以采用特異性靶向轉移性癌細胞的潛在治療方法。
這些發現激發了人們對研究核變形和 NE 破裂的興趣迅速增長,特別是在受限遷移期間。具有模擬體內間隙空間的定義收縮的微流體裝置已成為研究核變形和 NE 破裂在細胞遷移中的作用的有力工具。盡管此類設備的壁比體內的更堅硬在這些微流體裝置中獲得的細胞遷移空間、受限遷移和 NE 破裂結果與在膠原基質和活體成像研究中獲得的結果匹配,并且這些裝置能夠在的條件下對單細胞遷移進行延時成像定義的條件。在此類實驗中,通常通過熒光標記的 DNA(例如,用 Hoechst 33342 染色)或組蛋白(例如,H2B-tdTomato 的表達)來識別細胞核。可以通過監測含有核定位序列 (NLS-GFP) 的綠色熒光蛋白的細胞內定位來檢測 NE 破裂事件]. NLS-GFP 通常包含在細胞核內,但在 NE 破裂期間溢出到細胞質中,并在 NE 修復后逐漸重新導入細胞核(圖 1 )。使用癌細胞的延時實驗通常持續 6 到 24 小時,每 2 到 10 分鐘采集一次多色(熒光和透射光)圖像,從而產生大量(每個實驗 >40 GB)多維數據集幾天到幾周的時間來手動分析。在研究大量實驗條件時,這種低通量圖像分析提出了巨大的挑戰。此外,不同觀察者的手動分析可以為實驗數據增加很大的可變性。

圖。1
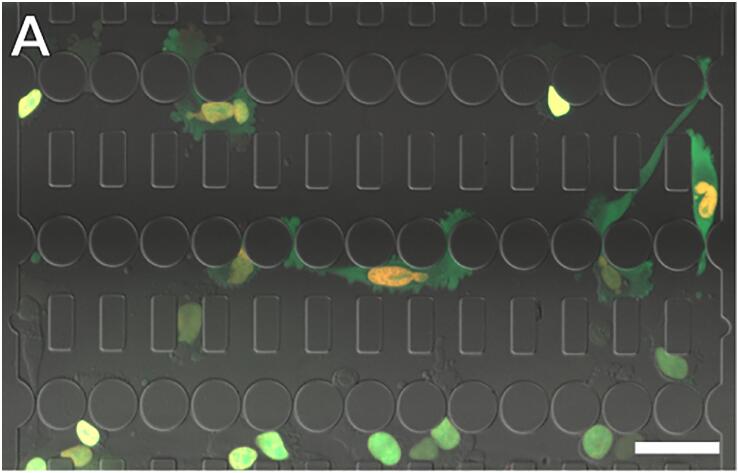
(A) 表達NLS-GFP和H2B-tdTomato的細胞通過微流體裝置遷移。比例尺:50um。(B) 細胞核擠壓收縮的時間序列。比例尺:bar 20um。
(C) NE破裂事件的時間序列。NLS-GFP在NE破裂時泄漏到細胞質中,并在NE修復時重新導入細胞核。比例尺:20um。
系統重要性
該系統自動進行圖像采集,自動進行通過孔隙的核轉運和核包膜破裂等事件的相應延時序列的分析,不受不同人差異操作的影響。
自動圖像分析程序來記錄微流體收縮并執行圖像分割以檢測單個細胞核。跟蹤核間的遷移,并記錄收縮過境事件、過境時間、過境成功率和核包殼破裂。
這種自動化將分析遷移實驗所需的時間從數周減少到數小時。收縮傳輸和核膜破裂都被正確可靠地檢測到,并且自動分析結果與手動分析金標準匹配。
該系統能夠檢測具有不同水平的核包膜蛋白層粘連蛋白A/C(控制核變形能力)的細胞之間核轉運時間的差異,并能夠檢測參與核包膜修復的蛋白CHMP7已被耗盡的
細胞中核膜破裂持續時間的增加。因此,該系統為研究受限遷移及其對細胞核的影響提供了一個通用的有力研究工具。
系統優勢特點:
自動化、可重現且穩健的過程執行圖像分析。該系統能夠跟蹤單個細胞/細胞核,因為它們通過微流體收縮通道遷移并計算單個收縮的傳輸時間。
雖然主要用于研究受限環境中的細胞遷移,但該系統也可用于研究在非受限二維基質上遷移的細胞。該系統還可以可靠地檢測 NE 破裂事件及其持續時間。
該程序會自動識別分裂細胞,從而提高穩健性和準確性,可與專家手動分析相媲美,但效率大大提高。
密閉環境中細微肌肉遷移和核膜破裂的自動分析流程圖(圖 2):
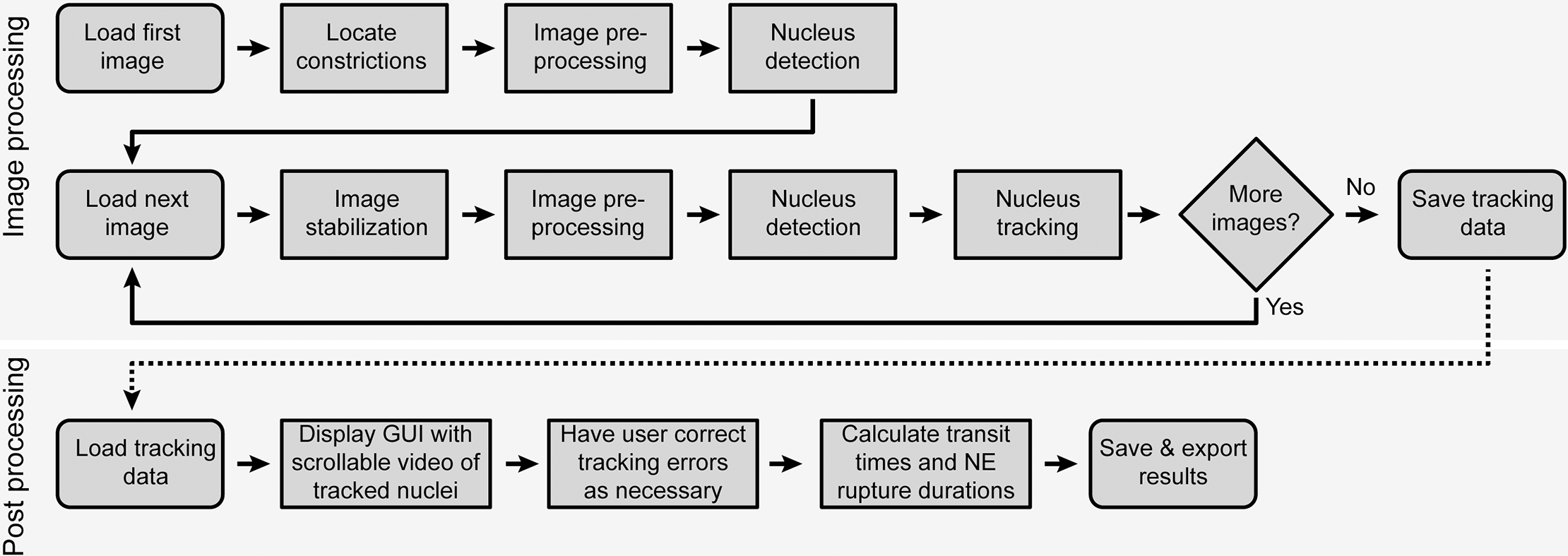
自動圖像分析從定位一張圖像中的收縮開始(圖 2)。然后處理圖像以減少噪聲并檢測熒光標記的細胞核。對于序列中的每個后續圖像,
執行圖像穩定以解決圖像采集期間視野中的小偏移。然后對每個圖像進行與上述相同的處理,以降低噪聲并檢測原子核。
已識別的細胞核從上一張圖像到當前圖像進行跟蹤。然后觀察所有細胞核的收縮通道和 NE 破裂的發生率。在分析完整序列后,
跟蹤結果將導出到電子表格并呈現給用戶進行手動驗證
微流體遷移裝置設計-微通道培養裝置及定位收縮(收窄)
通過識別形成三排收縮的微流體裝置中的圓柱來執行收縮位置(圖 1A和圖 S1)。這是通過對設備的透射光圖像應用圓形霍夫變換(一種識別圖像中圓圈的技術)來實現的。
然后旋轉所有圖像以水平對齊收縮行。虛擬邊界定義在收縮中心線上方和下方的特定距離處,以確定每行收縮的核進入和退出
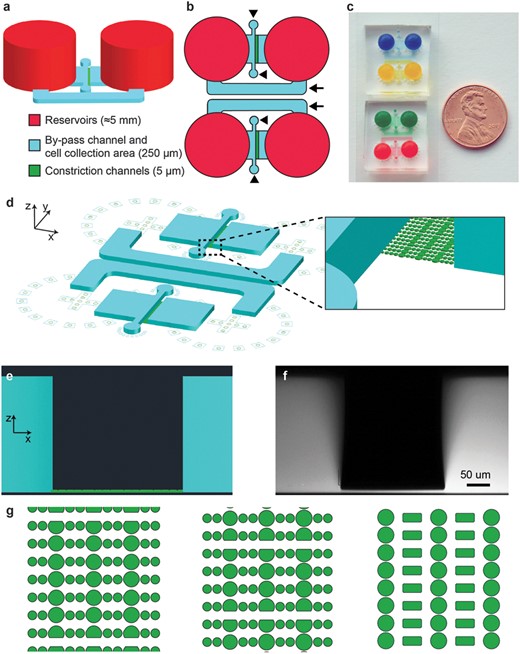
這些裝置由一系列PDMS柱形成的平行遷移通道組成,細胞通過這些通道沿著趨化梯度遷移(圖1)。通道可以用各種細胞外基質蛋白如膠原或纖連蛋白功能化以促進細胞粘附。
柱體形成的狹窄收縮模仿了細胞外基質和間隙中發現的2至30um寬的孔。趨化梯度是通過從大的源庫穿過收縮通道擴散到匯庫而建立的。兩個儲液器還通過一個250um高、1000um寬的旁通通道連接,為流體流動提供一條低阻力路徑,在設備操作過程中出現不均勻填充或機械擾動的情況下,允許儲液器之間的流體高度快速平衡。通過靠近收縮通道入口的兩個250um高×300um寬的端口,將細胞直接接種到收縮通道口部的250um高處。在收縮通道之前和之后這些區域的增加的高度確保了細胞有足夠的空間和充足的營養供應,同時便于容易裝載;如果需要,也可以在通過收縮后收集細胞,例如,以分析成功通過收縮的細胞和保留在另一側的細胞之間的基因表達差異。
細胞微通道培養裝置:
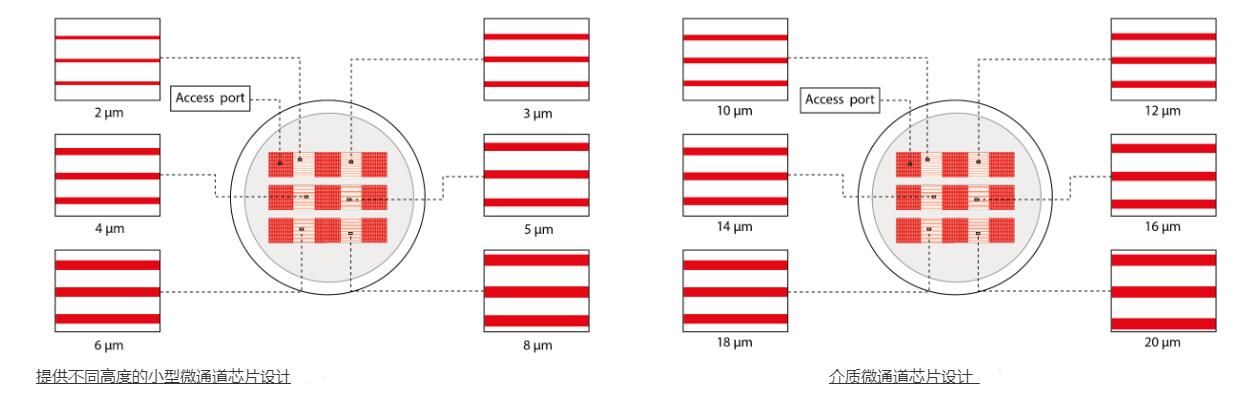
該設備包含一組細胞微通道培養裝置,尺寸可變,細胞可以在其中遷移:

PDMS 微通道已經綁定到 35 mm 玻璃底培養皿。
只需沖洗微通道,添加一些細胞外基質蛋白并加載您的細胞!
> 準備好使用
您只需要一個移液器來裝載您的細胞。
> 提供多種尺寸
從 3 到 1000um 寬度,適用于單細胞或集體遷移。
> 高質量的實時成像
玻璃底培養皿減少顯微鏡工作距離
>沿長度方向寬度可變的通道(模仿自然收縮)
>定制形狀和尺寸
>適用于 35 毫米培養皿
>與高分辨率光學顯微鏡系統兼容
> 材質:聚二甲基硅氧烷
> 如果此設備不能滿足您的需求,我們可以為您進行個性化定制

細胞核擠壓試驗,控制核膜破裂分析系統


 5
5




