實現高通量解析SARS-CoV-2刺突蛋白與不同抗體結合的表位結構

針對SARS-CoV-2刺突蛋白的治療性抗體可保護脆弱人群遠離嚴重或具有潛在威脅的疾病,這在幫助緩解當前肺炎疫情大流行中發揮著重要作用。冷凍電子顯微鏡(cryo-EM)是一種強大的儀器,可用于繪制阻斷SARS-CoV-2病毒入侵的抗體表位圖[1]。通過解析SARS-CoV-2和抗體結合的表位,可以使我們能夠了解它們之間的作用機制,并增加我們對抗體如何賦予保護性免疫力的認知。此外,對抗體表位和作用機制的精確了解,也可以指導抗體療法的改進,生產新的抗體治療藥物。例如,冷凍電鏡解析了刺突蛋白和不同抗體的非重疊結合表位,從而促進了 “抗體雞尾酒" 療法的研發,降低了病毒逃逸的風險[2]。
目前, 肺炎疫情大流行的主要原因之一是SARS-CoV-2 不斷變異,新變異毒株可能逃避免疫。其中一個便是Omicron(B.1.1529)變異株,在其與受體結合區域 (receptor-binding domain) ,含有迄今為止最多的突變位數量。刺突蛋白和抗體結合的表位結構,能快速識別刺突蛋白脆弱位點,并預測和解釋新突變可能帶來的影響,還能加快針對非重疊結合表位的抗體組合決策選擇效率。此外,關于表位的結構信息,可以幫助確定新的藥物研發管線,以應對新出現的變體。因此,如何使用冷凍電鏡加速抗原抗體表位篩選成為我們所考慮的問題之一。
在這里,我們將探討如何通過 Thermo Scientific™ EPU 軟件 的EPU Multigrid收集功能將 cryo-EM 用于高通量表位作圖。在本研究中,我們從 12 種臨床前階段抗體中,生成并表征了一組針對受體結合域的特異性SARS-CoV-2中和抗體。這組抗體代表了一系列 SARS-CoV-2 抗體的中和效力、親和力及其余六種粗表位庫。這六種抗體表位庫中,大部分抗體來自 肺炎 患者,另一些來自人抗IgG 動物的免疫接種。在此, 我們展示了如何從為期 2 天的無人值守冷凍電鏡中,在12 個含有不同 Fab 的spike-Fab復合物的載網上獲得12個優于3 ?的刺突蛋白結構(圖 1)。

圖1. 使用EPU Multigrid在200kV Glacios Cryo-TEM上實現的SARS-CoV-2刺突蛋白抗體的高通量冷凍電鏡表位圖。
我們使用Glacios Cryo-TEM和Falcon 4直接電子檢測相機對SARS-CoV-2刺突蛋白進行單顆粒分析。在此實驗中,在1.5小時內收集了28,162個顆粒,并計算重構了一個3.1埃的刺突蛋白膜外區結構(圖2)。
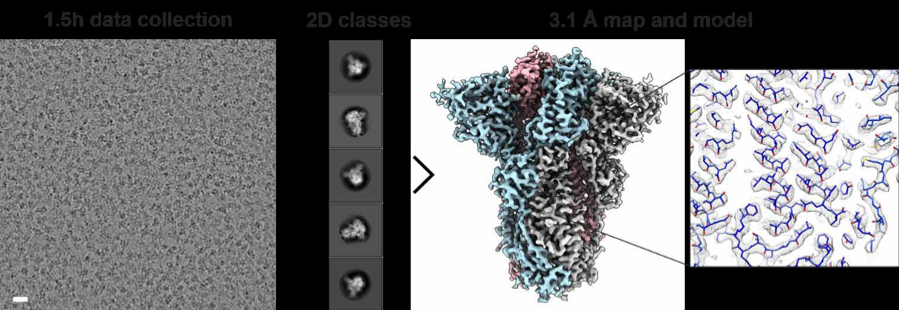
圖2. 使用Glacios Cryo-TEM和Falcon 4直接電子檢測相機對SARS-CoV-2刺突蛋白進行單顆粒分析。右圖,代表包含搭建原子結構的密度圖(PDB ID:6XR8)。
EPU Atlas Screening用于收集總共24個載網的圖像,并從中選出12個最佳的載網進行數據采集。EPU Multigrid可以通過使用 "Max Exposures "選項限制每個載網拍攝的圖像數量來進行篩選工作。為了衡量我們的12個載網是否具有解析高分辨結構的質量,我們在Glacios Cryo-TEM上使用EPU Multigrid,為每個spike-Fab復合物收集50張圖像。將這些小數據集在cryoSPARC Live軟件中進行預處理[3]。在獲得良好的預處理結構后,我們繼續對12個經過篩選的載網使用Thermo Scientific Krios™ G4 Cryo-TEM進行無人值守EPU Multigrid數據收集(其中Krios™ G4配備了E-CFEG冷場電子槍、Thermo Scientific Selectris™ X能量過濾器和Thermo Scientific Falcon 4直接電子檢測相機)。我們將EPU Multigrid設置為每個載網收集1,000張圖像,實現了每小時250張圖像的速度。數據采集參數請見表1。

表1.冷凍電鏡數據收集參數
使用4塊GPU的工作站進行數據處理,每個數據集處理耗時約12小時,計算結構顯示12個spike-Fab復合物的分辨率都優于3 ?(見表2)。
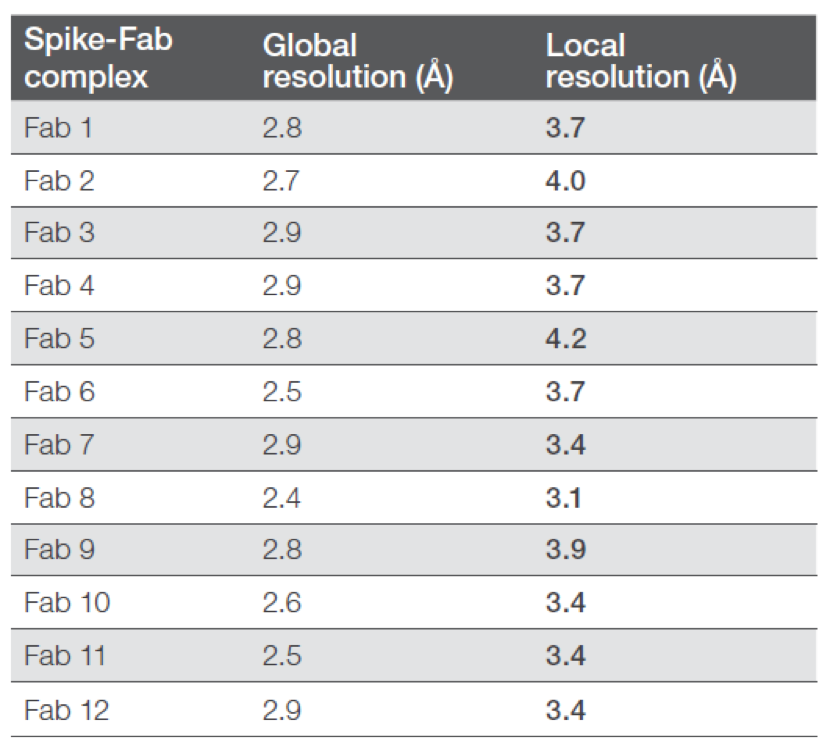
表2. 不同spike-Fab復合物的整體和局部分辨率。
使用cryoSPARC軟件對Krios G4 Cryo-TEM收集的數據進行3埃內的結構重建。在漂移校正和CTF校正后,使用blob picker挑選顆粒,4x binning提取顆粒,并進行二維分類。本研究中的Fabs來自臨床前開發階段的抗體,其特征在于SARS-CoV-2和變異假病毒的中和等特征。在此,我們突出顯示了來自12個Spike-RBD中S2和RBD的密度,以代表整體分辨率和局部分辨率(圖3)。

圖3. 本研究中的12個spike-Fab復合物的S2和RBD的代表性密度。S2通常是刺突蛋白中分辨率最高的部分。因此,S2的密度代表了整體分辨率。相反,RBD-Fab區域是多變的,通常分辨率很低。在這項研究中。對RBD-Fab區域進行了local refinement,以提高表位的局部分辨率。因此,RBD密度代表了與表位相鄰區域的局部分辨率。
冷凍電鏡更快速的數據收集與EPU Multgrid功能的實現,促進了基于片段的藥物發現和抗原抗體結合表位的高通量篩選[4]。

想要了解更多,微信掃碼即可獲取原文件
References
1. C. O. Barnes et al., SARS-CoV-2 neutralizing antibody structures inform therapeutic strategies, Nature, vol. 588, no. 7839, pp. 682–687, Dec. 2020.
2. J. Hansen et al., Studies in humanized mice and convalescent humans yield a SARS-CoV-2 antibody cocktail, Science (New York, N.Y.), vol. 369, no. 6506, pp. 1010–1014, Aug. 2020.
3. A. Punjani, J. L. Rubinstein, D. J. Fleet, and M. A. Brubaker, cryoSPARC: algorithms for rapid unsupervised cryo-EM structure determination, Nature Methods, vol. 14, no. 3,
pp. 290–296, 2017.
4. M. Saur et al., “Fragment-based drug discovery using cryo-EM," Drug Discovery Today, vol. 25, no. 3, pp. 485–490, 2020.



 6
6
